-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaJak na psoriázu v každodenní ambulantní praxi?
Datum publikace: 6. 5. 2019
Úvod
Psoriáza je chronickým zánětlivým imunitně podmíněným onemocněním kůže. Její prevalence v evropské populaci se pohybuje mezi 2 a 3 % (1). Charakteristickými projevy choroby jsou zarudlá ložiska pokrytá šupinami, která se typicky vyskytují v oblasti extenzorových ploch končetin a na zádech, ale mohou se vyskytovat na kterémkoliv místě na těle. Rozsah a závažnost onemocnění jsou hodnoceny zejména pomocí skórovacího systému PASI (angl. Psoriasis Area and Severity Index). Pomocí tohoto indexu hodnotíme míru zarudnutí, zašupení a tloušťku ložisek psoriázy v kombinaci s rozsahem postižení. Index PASI lze nejrychleji spočítat pomocí tzv. PASI kalkulátorů, volně dostupných v podobě webových či mobilních aplikací. Nejvyšší bodové hodnocení PASI skóre je 72 a nejnižší 0. Rozsah psoriázy je možné hodnotit také pomocí indexu BSA (angl. Body Surface Area), jehož hodnoty mohou dosahovat 0–100 %, kdy velikost plochy pacientovy ruky odpovídá jednomu procentu postižení. Nejjednodušším skórovacím systémem je PGA (angl. Physician Global Assessment), často používaný zejména při klinických studiích. Pomocí PGA lékař hodnotí aktuální stav pacienta dle přesně definované škály. V rámci hodnocení psoriázy se většinou využívá škály, která nabývá hodnot mezi 0 a 4, kdy 0 odpovídá stavu bez projevů psoriázy, 1 velmi mírnému postižení, 2 mírnému postižení, 3 střednímu postižení a 4 vážnému postižení. Alternativou PGA je skórovací systém PaGA (angl. Patient Global Assessment), kdy závažnost psoriázy nehodnotí lékař, ale samotný pacient a hodnoticí škála je pětistupňová, přičemž vyšší hodnota znamená vážnější postižení (2). V České republice nejpoužívanějším skórovacím systémem hodnotícím psychosociální dopady onemocnění na kvalitu života pacienta je dotazník DLQI (angl. Dermatology Life Quality Index), ve kterém pacient odpovídá na 10 otázek týkajících se vlivu psoriázy na jeho běžné aktivity. Výsledné skóre nabývá hodnot v rozmezí 0–30, kdy hodnoty vyšší než 5 odpovídají výraznějšímu ovlivnění pacientova života psoriázou. Kromě dotazníku DLQI existuje celá řada dalších dotazníků, které se podrobněji zaměřují na vliv psoriázy na kvalitu života pacientů a na efekt terapie. V dotazníku PBI (angl. Patient Benefit Index) je pacienty hodnoceno, do jaké míry bylo dosaženo terapeutických cílů vytyčených na začátku léčby. V dotazníku TSQM-9 (angl. Treatment Satisfaction Questionnaire for Medication) pacienti hodnotí, jak jsou spokojení s dosavadní léčbou. Dotazník Q-LES-Q-SF (angl. Quality of Life Enjoyment and Satisfaction Questionnaire – Short Form) obsahuje otázky týkající se spokojenosti pacienta s kvalitou života (3).
Primárním cílem léčby psoriázy je převést symptomatickou formu psoriázy do klinicky latentní formy onemocnění s minimem viditelných projevů, ideálně do podoby zcela čisté kůže prosté od projevů psoriázy. U pacientů s mírnou formou psoriázy je k dosažení remise dostačující většinou topická terapie, u pacientů s těžšími formami (PASI > 10) je většinou potřebná celková léčba.
Před zahájením jakékoliv terapie psoriázy by měla být dermatologem vyhodnocena závažnost onemocnění (PASI, BSA) i jeho vliv na kvalitu života pacienta (DLQI). Při dalším sledování se pomocí těchto skórovacích mechanismů snáze hodnotí účinnost zvolené terapie a plánuje další léčebný postup (obr. 1).
Obr. 1. Algoritmus terapeutického postupu (4) 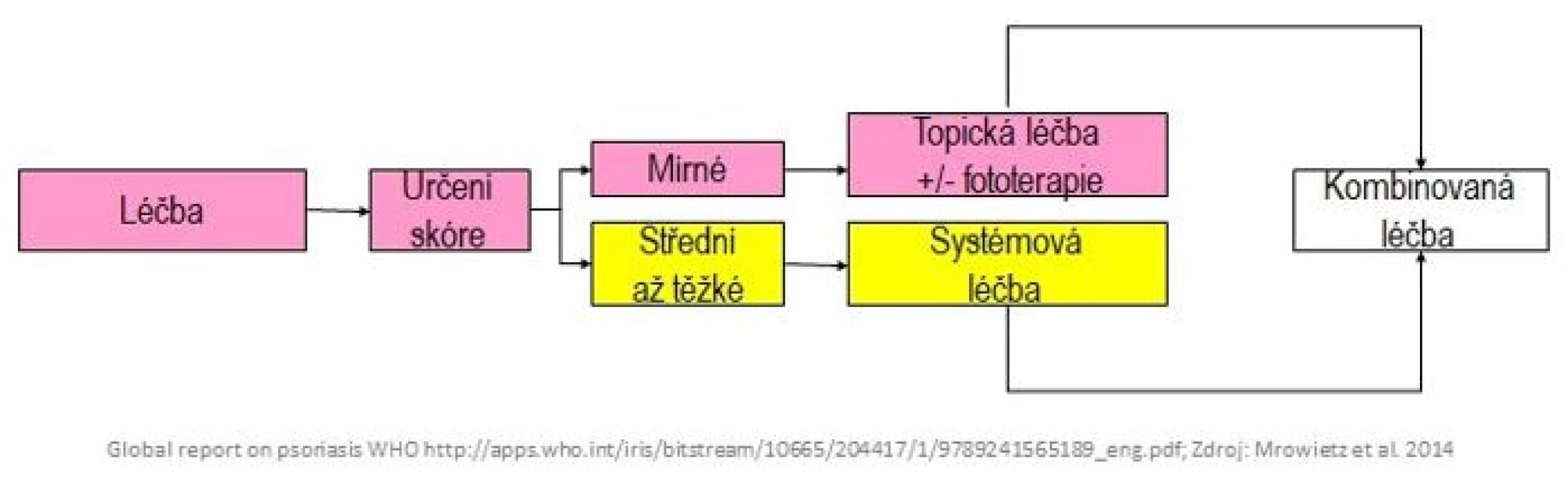
Zevní terapie
Pacienti s mírnou variantou psoriázy jsou účinně léčeni pomocí topických přípravků. Zevní terapie má svůj význam i u pacientů s těžšími formami, kteří jsou léčení systémovou léčbou a u nichž zevní terapie hraje roli doplňkové léčby, za jejíž pomoci jsou ošetřována reziduální ložiska. Zevní terapie tak zůstává nedílnou součástí úspěšné léčby všech typů psoriázy. Za zlatý standard topické léčby jsou dnes považovány kombinované preparáty obsahující kortikosteroid a derivát vitamínu D (kalcipotriol). Kalcipotriol indukuje diferenciaci keratinocytů a tlumí jejich proliferaci a souběžně stimuluje tvorbu kolagenu, čímž snižuje atrofogenní potenciál kortikoidů, na druhé straně kortikoidy neutralizují iritační potenciál kalcipotriolu (5). Alternativou kombinovaných preparátů je monoterapie analogy vitamínu D3 či kortikoidními přípravky. Četnost aplikace kortikoidních extern by měla reflektovat aktivitu choroby. Při akutním zhoršení je vhodné přípravek aplikovat 1–2× denně, po zklidnění nálezu je ideální přejít na tzv. intervalovou léčbu – kortikoidy aplikovat pouze některé dny (např. obden nebo pouze o víkendu) a v ostatních dnech na ložiska psoriázy aplikovat emoliencia. Kortikosteroidní přípravky dělíme dle síly účinné látky do 4 tříd, použití nejsilnější, 4. třídy je vyhrazeno na refrakterní ložiska psoriázy. Na ložiska psoriázy lokalizovaná v oblasti hlavy a krku je vhodné používat spíše slabší (1. či 2. třídy) kortikoidní přípravky (6). Mezi nežádoucí účinky dlouhodobé terapie kortikoidy řadíme zejména atrofii kůže, rozvoj purpury, strií, angiektazií či hypertrichózy. Kromě obav pacientů z rozvoje nežádoucích účinků při kortikoidní terapii je obecně největším úskalím zevní terapie adherence pacientů k této léčbě. Nejvyšší míra adherence je popisována na začátku léčby a při aplikaci extern 1× denně. S doporučením četnějších aplikací či při nedostatečném efektu terapie adherence pacienta k terapii klesá, a proto je důležité pacienta náležitě poučit o nutnosti pravidelných aplikací extern a pokusit se pro něj zevní terapii co nejvíce zjednodušit, tak aby věděl, jak a čím se má v domácím prostředí ošetřovat. Častým úskalím úspěšné léčby bývá také pacientův nepřesný odhad potřebného množství aplikovaného externa. V případě aplikace menšího množství léčiva tak může dojít k nedostatečnému účinku léčby anebo v případě aplikace přílišného množství k riziku rozvoje nežádoucích účinků terapie (7). Pro správný odhad vhodného množství aplikovaného externa lze použít tzv. jednotku prstového bříška ukazováku (zkr. FTU z angl. fingertip unit), kdy externum vytlačené z tuby (tvar válečku) s ústím o průměru 5 mm pokrývá oblast palmární plochy kůže distálně od distální flekční rýhy na 2. prstu ruky (obr. 2). Tato jednotka u dospělého muže váží 500 mg (u ženy 400 mg) a její množství je dostačující k aplikaci na obě dlaně a palmární plochu prstů. Pro ošetření obličeje a krku je potřeba 2,5 jednotky, pro ošetření trupu cca 14 jednotek, paže a předloktí 3 jednotky, stehna a lýtka 6 jednotek a na nohu je potřeba aplikovat cca 2 jednotky (8).
Obr. 2. Jednotka prstového lůžka – zkr. FTU z angl. fingertip unit (8) 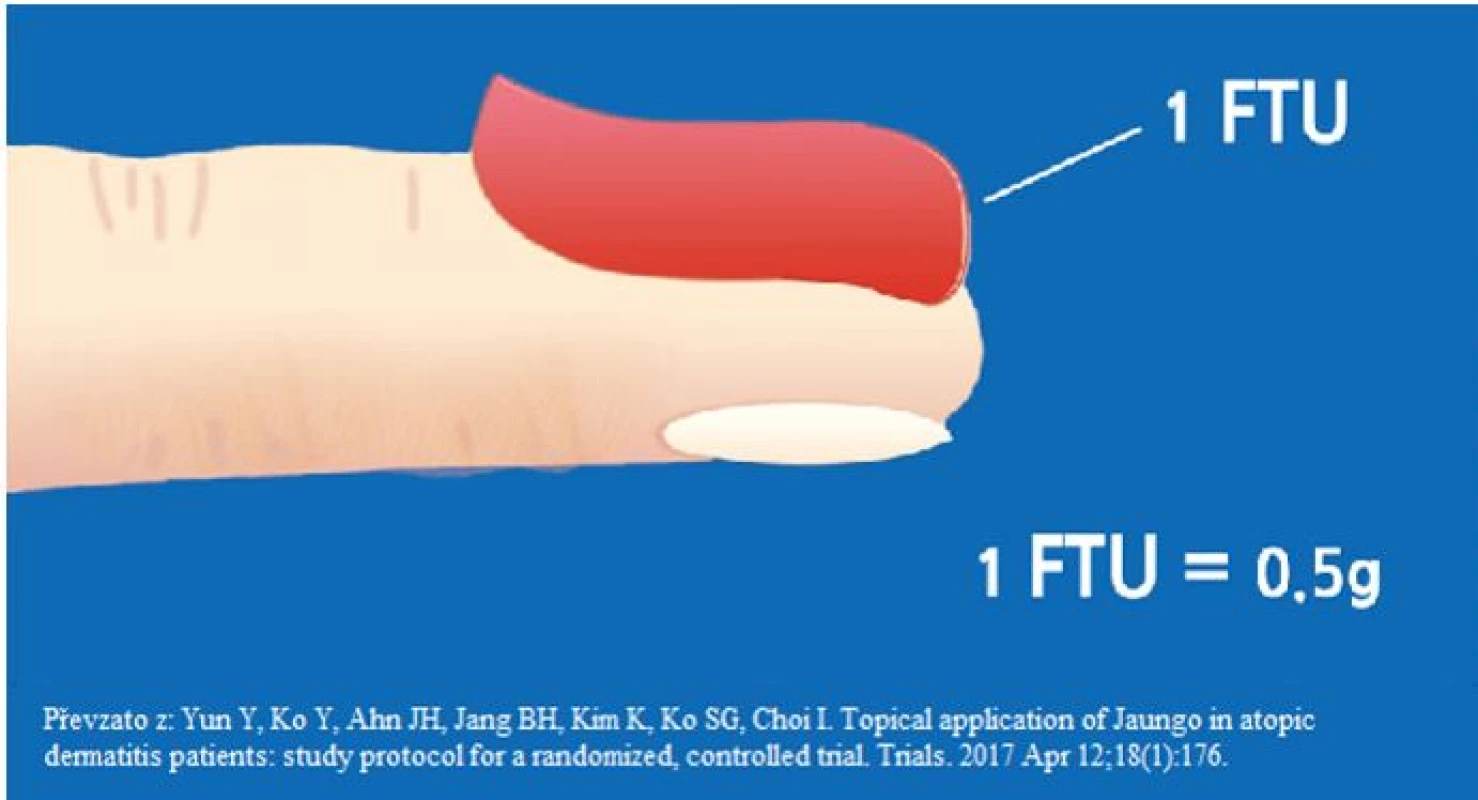
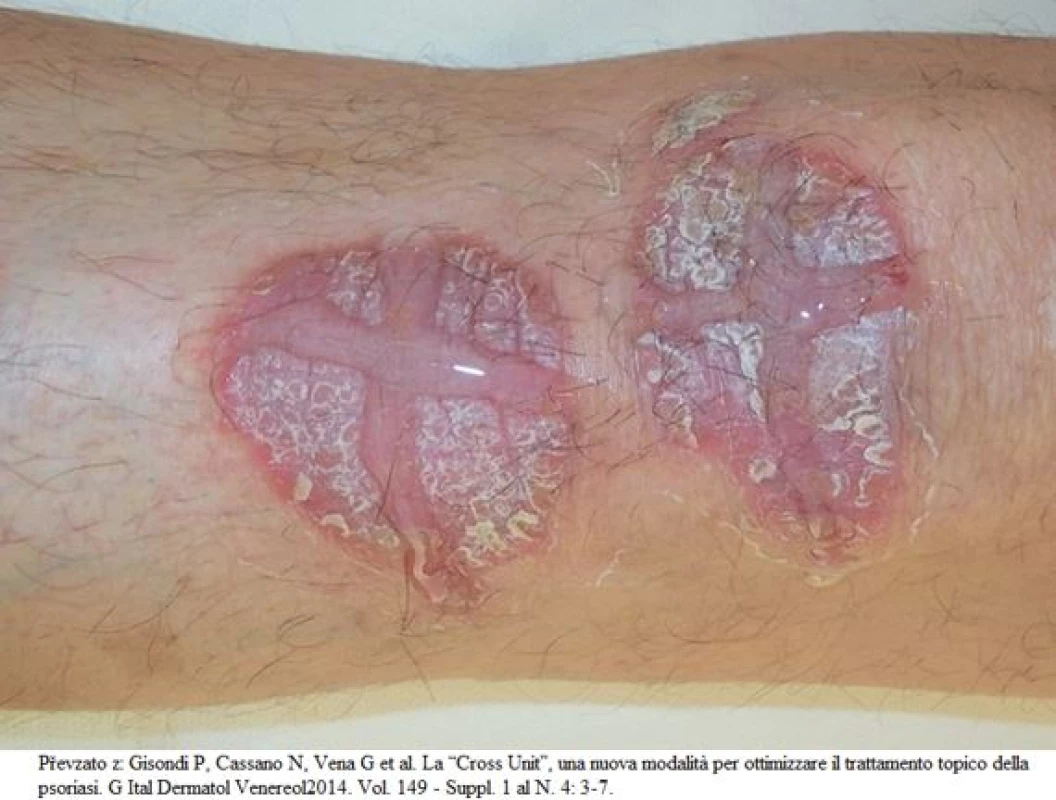
Další metodou, která je snazší na interpretaci i na použití v praxi při léčbě ohraničených ložisek, je tzv. cross unit metoda. Tento způsob spočívá v aplikaci externa ve dvou na sobě kolmých osách překlenujících ošetřované ložisko, jak je patrné na obrázku 3 (9). Tato metoda je vhodná zejména u gelových forem.
Adherence pacienta k zevní terapii rovněž výrazně koreluje s použitou lékovou formou (vehikulum). V terapii psoriázy můžeme použít celou řadu různých vehikul, od mastí, krémů, roztoků, gelů a past až po pěny nebo šampony. Výběr vhodného vehikula závisí na místu určení aplikace daného přípravku nebo aktuálním kožním nálezu a také je potřeba zohlednit preference samotného pacienta. Univerzálním vehikulem, které se dá aplikovat prakticky do jakýchkoliv oblastí na kůži, je pěna.
V topické terapii psoriázy mají svou nezastupitelnou roli i emoliencia, dehty, cignolin a také balneoterapie. Vzhledem k jejich slabšímu účinku ve srovnání s kortikoidními přípravky je jejich použití rezervováno zejména pro doplňkovou terapii ke kortikoidní léčbě či v rámci udržovací terapie ve fázi remise onemocnění.
Mezi dehtové preparáty běžně používané v dermatologii řadíme kamenouhelný dehet a ichtamol. Kamenouhelný dehet vzniká suchou destilací černého uhlí a má mnoho účinků závislých na použité koncentraci a vehikulu. Zejména se jedná o antiflogistické, adstringentní, antiproliferativní, antiprurigiózní, antimykotické a antimikrobiální účinky. Známé jsou také výrazné fotosenzibilizující účinky, kterých se využívá v kombinaci s UVB zářením v rámci Goeckermanovy metody terapie psoriázy. Mechanismy působení kamenouhelného dehtu nejsou zcela jasné, zřejmý je supresivní účinek dehtu na syntézu DNA, která vede k redukci epidermální hyperproliferace a k normalizaci porušené diferenciace keratinocytů. Jeho použití je vhodné zejména pro chronickou stacionární psoriázu a pro možný rozvoj systémových účinků v podobě hepatotoxicity a nefrotoxicity je nutné se vyvarovat aplikace na příliš velké plochy kožního povrchu. Pro terapii psoriázy dospělých používáme většinou 1–5% koncentrace kamenouhelného dehtu v masťovém či pastovém základu. U dětí do jednoho roku je jeho použití kontraindikováno. Terapie kamenouhelným dehtem je vyhrazena zejména pro nemocniční terapii, mimo jiné i proto, že je spojená se specifickým zápachem a také zabarvením kůže a oblečení. Tyto nevýhody částečně odstraňuje použití liquor carbonis detergens, což je roztok 35% kamenouhelného dehtu v lihovém extraktu z quillaiové kůry. Tento přípravek má nižší iritační potenciál, méně špiní a nemá fotosenzibilizující účinky. Tento roztok lze aplikovat přímo na patologická ložiska a nechat zaschnout.
Ichtamol je směs látek získaná suchou destilací břidlic s následnou sulfonací živičných olejů s vyšším obsahem síry. V terapii psoriázy využíváme jeho protizánětlivé, keratoplastické a protisvědivé účinky. Na rozdíl od kamenouhelného dehtu je ichtamol zatížen minimem nežádoucích účinků, není fotosenzibilizační ani nemá toxické či karcinogenní účinky, což umožňuje jeho použití i v dětském věku. V terapii psoriázy využíváme většinou 2–5% koncentraci ichtamolu ve formě mastí či krémů (10).
Antralin (cignolin, dithranol) je indikován v léčbě mírné a středně těžké psoriázy, kde využíváme jeho výrazné antiproliferativní účinky. Léčba probíhá ve formě tzv. minutové terapie ve stacionářích nebo při hospitalizaci. Antralin je aplikován na ložiska lupénky a po několika minutách je dle efektu a tolerance odstraněn. Maximální koncentrace antralinu v přípravku je 4 %, maximální doba působení je 30 minut. Nejčastějším nežádoucím účinkem je vznik iritační dermatitidy a hojení hyper - nebo hypopigmentacemi. Antralin lze používat v kombinaci s působením UV záření jako tzv. Ingramovu metodu terapie psoriázy (11).
Systémová terapie
Dalšími možnostmi terapie psoriázy jsou tzv. systémové konvenční terapie psoriázy, kam řadíme fototerapii, terapii methotrexátem, cyklosporinem A a acitretinem.
Při celkové léčbě psoriázy je vždy nutné zvážit poměr rizik k přínosu dané léčby. Úspěch léčby závisí nejen na zvoleném preparátu, ale i na míře spolupráce pacienta, na které se velkou měrou podílí dostatečná informovanost nemocného a adekvátní edukace o plánovaném průběhu léčby lékařem. Hranicí rozlišující úspěšnou léčbu od neúspěšné je dosažení PASI 50, tedy redukce psoriatického zánětu o 50 %. Pokud není dosaženo alespoň PASI 50, je indikována změna celkové terapie. Změna terapie je také indikována v případech, kdy sice došlo k objektivnímu zlepšení klinického nálezu o 50–75 % (PASI 50–75), ale pacient je onemocněním nadále značně stigmatizován (DLQI > 5) – obr. 4 (12).
Obr. 4. Algoritmus systémové terapie (12) 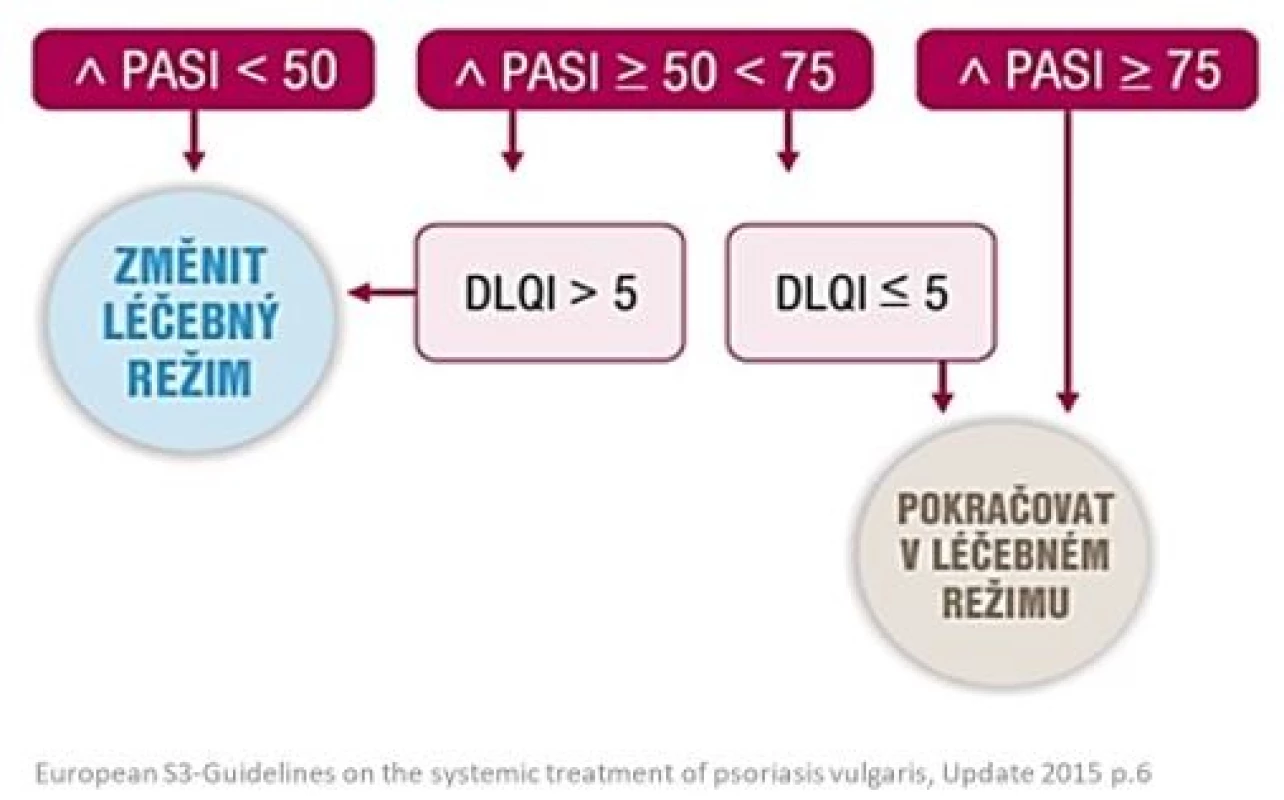
Fototerapie
Nejpoužívanější fototerapeutickou metodou je celotělově působící záření UVB spektra o vlnové délce 311 nm. Vzhledem k horší dostupnosti oxsoralenu v České republice se PUVA fototerapie pro léčbu psoriázy již příliš nevyužívá. Celotělová 311nm UVB fototerapie je vhodná zejména pro rozsáhlejší formy onemocnění, je spojená s nízkým rizikem vedlejších účinků a je možné ji kombinovat s takřka všemi ostatními metodami terapie (striktně kontraindikován je pouze cyklosporin A). Nevýhodou 311nm UVB fototerapie je její časová náročnost spojená s horší dostupností. Fokusovaná fototerapie pomocí excimerového laseru o vlnové délce 308 nm má největší uplatnění v terapii lehčích, ale torpidnějších forem chronické ložiskové psoriázy. Výhodou je rychlý nástup účinku a menší časová náročnost pro pacienta, nevýhodou je jeho dostupnost pouze na některých klinických pracovištích či v soukromých centrech. Fototerapie je obvykle dobře snášena, opatrnosti je potřeba u pacientů s nízkým fototypem, kde je nutno dávku záření navyšovat velmi pozvolna. Fototerapie je kontraindikována u pacientů s anamnézou fotosenzitivního onemocnění (např. systémová onemocnění pojiva), se syndromem dysplastických névů či s anamnézou kožních neoplazií a obezřetnosti je třeba také u pacientů s bohatou interní medikací, kdy jednotlivé léky či jejich interakce mohou být zdrojem fotosenzitivity. Frekvence ozařování bývá většinou 2–5× týdně s pozvolným zvyšováním dávky ultrafialového záření (13, 14).
Terapie methotrexátem, cyklosporinem A či acitretinem je indikována u středně těžké až těžké formy psoriázy (PASI > 10, BSA > 10), případně u takových forem psoriázy, které pacienta značně stigmatizují (psoriáza obličeje, rukou, genitálu) a významně snižují kvalitu jeho života (DLQI > 5; 15). Vzhledem k riziku rozvoje nežádoucích účinků je nutné pacienty pravidelně sledovat včetně provádění kontrolních laboratorních vyšetření (tab. 1; 16, 17). Veškerá vyšetření lze provádět a pacienta sledovat na kterémkoliv dermatologickém pracovišti, u komplikovaných případů lze zvolený postup konzultovat se specializovanými centry pro biologickou léčbu psoriázy.
Tab. 1. Doporučené laboratorní odběry při systémové terapii psoriázy (16, 17) 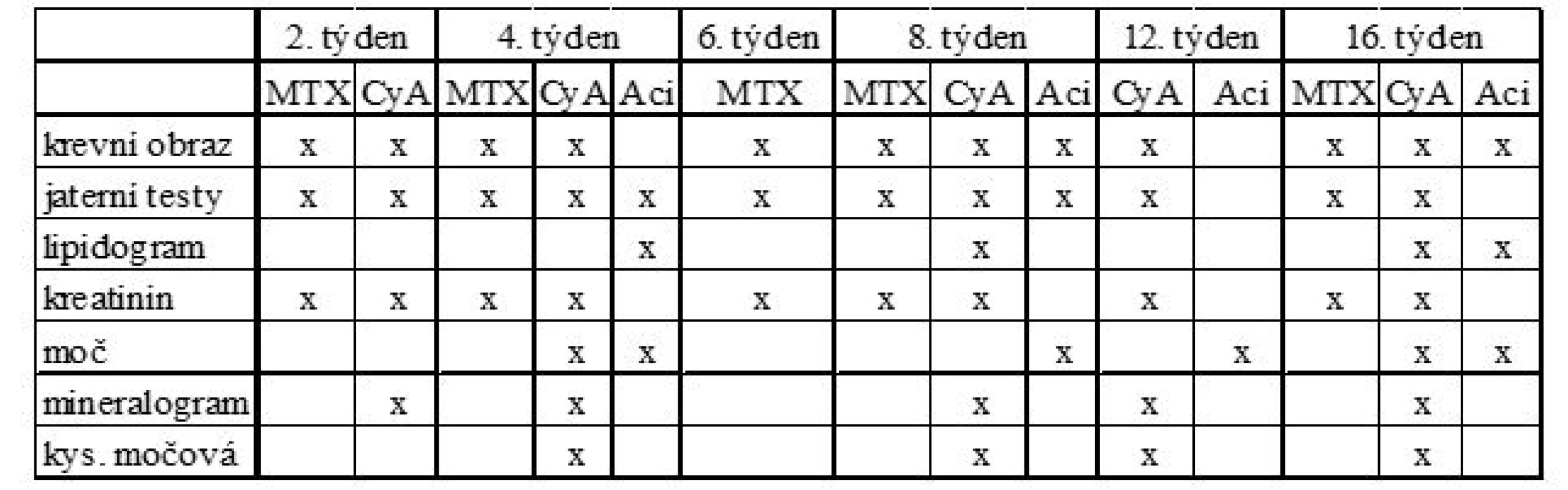
Pozn.: MTX = methotrexát, CyA = cyklosporin A, Aci = acitretin, při terapii acitretinem se vyšetřuje moč pouze u žen k vyloučení gravidity Cyklosporin A
Cyklosporin A je imunosupresivum, tlumící imunitní reakce zprostředkované buňkami včetně tvorby interleukinů v T lymfocytech. Dávkování cyklosporinu je závislé na hmotnosti pacienta. Iniciální dávka je většinou 2 mg/kg hmotnosti pacienta za den. Dávku je možno postupně zvyšovat až na 5 mg/kg. Při dostatečném efektu dávku postupně snižujeme až na nejnižší účinné množství. Před zahájením terapie cyklosporinem je nutné vyšetřit krevní obraz včetně diferenciálního rozpočtu leukocytů, mineralogram (Na, K, Mg), jaterní enzymy (ALT, AST, ALP, GGT), hodnoty kyseliny močové, cholesterolu, triglyceridů a kreatininu, močový sediment a krevní tlak. V průběhu léčby je nutné měření hodnot krevního tlaku včetně provádění laboratorních odběrů pravidelně opakovat (tab. 1). Nejčastějšími nežádoucími účinky terapie cyklosporinem jsou nefrotoxicita, hypertenze, gingivální hyperplazie, tremor, bolesti hlavy, únavnost, elevace sérových hodnot lipidů, hypertrichóza a pocity pálení dlaní a chodidel. Vzhledem k riziku rozvoje fixované hypertenze a riziku kancerogeneze se nedoporučuje pokračovat v terapii déle než 2 roky. Cyklosporin je metabolizován systémem cytochromu P450, z čehož plyne riziko rozvoje častých lékových interakcí. U pacientů s onemocněním ledvin či laboratorními známkami ledvinného postižení je terapie cyklosporinem kontraindikována, u pacientů s kompenzovanou hypertenzí lze lék použít po předchozí konzultaci s lékařem, který předepisuje antihypertenzní medikaci. Cyklosporin je kontraindikován také u pacientů s probíhající závažnou infekcí či anamnézou maligního onkologického onemocnění. Předností terapie cyklosporinem je rychlý nástup účinku a možnost použití preparátu u osob ve fertilním věku bez obav z teratogenních účinků, i když terapie cyklosporinem může mít nepříznivý vliv na výsledky těhotenství. Cyklosporin využíváme zejména ke krátkodobé léčbě (3–6 měsíců) k navození remise onemocnění s možností opětovného zahájení terapie (tzv. cyklická terapie; 12, 18).
Acitretin
Acitretin je lékem ze skupiny tzv. retinoidů, jedná se o syntetický derivát vitamínu A. Má účinky upravující patologickou keratinizaci a má také imunomodulační a protizánětlivé účinky. Frekvence dávkování je 1× denně, dávka léku je závislá na hmotnosti pacienta. Iniciální je obvykle dávka 25 mg denně s možností postupného navyšování dle efektu a tolerance. Dlouhodobá léčba se u psoriázy nedoporučuje, zkušenosti jsou s kontinuální léčbou trvající 2 roky. Vzhledem k tomu, že je acitretin rozpustný v tucích, je pro maximální resorpci vhodné užívat lék souběžně s tučným nápojem či jídlem (ideálně mlékem). Nežádoucí účinky jsou závislé na dávce a většinou jsou reverzibilní. Nejčastějším nežádoucím účinkem léčby bývá xeróza kůže a sliznic (zejména rtů), alopecie, fotosenzitivita, elevace sérových hladin lipidů a jaterních enzymů. Nejzávažnějším nežádoucím účinkem je významný teratogenní efekt acitretinu. Proto pacientky léčené acitretinem musí používat účinnou antikoncepci bez přerušení po dobu 1 měsíce před zahájením léčby, po celou dobu léčby a 3 roky po jejím ukončení. Je třeba používat alespoň 1 vysoce účinnou metodu antikoncepce (tj. ve formě nezávislé na uživateli) nebo 2 doplňkové formy antikoncepce závislé na uživateli. Těhotenský test s negativním výsledkem musí být proveden před započetím léčby a během terapie mají být těhotenské testy prováděny v měsíčních intervalech. Po ukončení léčby mají být prováděny těhotenské testy v intervalech 1–3 měsíců po dobu 3 let po ukončení léčby. Přípravek nesmí být podáván kojícím matkám. Z důvodu těchto významných teratogenních účinků preparátu je vhodnější acitretin nepodávat ženám ve fertilním věku, kontraindikován je u žen plánujících graviditu. Před zahájením terapie acitretinem je nutné provést vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů, jaterními enzymy, glykémií, hodnotami cholesterolu, triglyceridů a kreatininu. U žen ve fertilním věku je nutné provést těhotenský test. V průběhu léčby je nutné laboratorní odběry pravidelně opakovat (tab. 1). Acitretin je u ložiskové psoriázy obvykle méně účinný v běžných dávkách, ve vyšších dávkách často dochází k rozvoji nežádoucích účinků, a tak je léčba pacienty hůře tolerována (12, 17, 19). Nejčastější využití nachází acitretin zejména u pustulózních a palmoplantárních forem psoriázy.
Methotrexát
Methotrexát je analogem kyseliny listové a jeho účinkem dochází k inhibici syntézy DNA a RNA. Inhibice produkce nukleových kyselin v aktivovaných T lymfocytech a keratinocytech vysvětluje antiproliferační a imunosupresivní účinky methotrexátu. Methotrexát využíváme zejména u těžších forem psoriázy, případně u forem s přidruženým kloubním onemocněním. Vzhledem k riziku rozvoje nežádoucích účinků léčby v podobě myelosuprese či hepatotoxicity je nutné zejména na začátku léčby provádět časté laboratorní kontroly. Před zahájením terapie a před podáním druhé dávky methotrexátu je nezbytné provést vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů, abychom odhalili případný rozvoj myelotoxicity. Kromě monitorace krevního obrazu je nutné před zahájením terapie provést vyšetření hodnot jaterních enzymů, albuminu, močového sedimentu a kreatininu a u žen ve fertilním věku doplnit vyšetření k vyloučení gravidity. Vzhledem k imunosupresivnímu účinku methotrexátu se doporučuje vyloučit infekční hepatitidy, u rizikových skupin také infekci HIV a tuberkulózu. V průběhu léčby methotrexátem je nutné laboratorní odběry pravidelně opakovat (tab. 1). Methotrexát také může mít vliv na rozvoj či progresi intersticiální plicní fibrózy, a proto by mělo být v pravidelných intervalech prováděno i rentgenové vyšetření hrudníku (1× ročně). Mezi nejčastější nežádoucí účinky patří nauzea, únava, vypadávání vlasů, elevace jaterních enzymů, myelosuprese, vznik gastrointestinálních vředů a deprese. Nezanedbatelné jsou také teratogenní účinky methotrexátu a jeho vliv na fertilitu, a proto musí muži i ženy během terapie a 6 měsíců po jejím skončení používat účinnou metodu kontracepce. Frekvence dávkování methotrexátu je zpravidla 1× týdně. Následující den je doporučena medikace 5 mg kyseliny listové. Výše dávky methotrexátu závisí na závažnosti psoriázy, ale obvyklou iniciační dávkou je 10 mg 1× týdně. Dle efektu terapie je možno dávku methotrexátu postupně snižovat či případně navyšovat až na 25 mg týdně. Při rozvoji nežádoucích účinků v podobě gastrointestinálních potíží v návaznosti na užití methotrexátu je možno zaměnit perorální způsob podávání léku za subkutánní aplikace pomocí předplněného pera. Tato forma aplikace je zpravidla provázena nižší intenzitou gastrointestinálních potíží. Z konvenční systémové terapie je methotrexát nejvhodnější pro dlouhodobější kontrolu onemocnění (12, 20).
Veškeré výše uvedené způsoby terapie mohou být indikovány a vedeny spádovými dermatology. Pakliže ale nevedou k dostatečné terapeutické odezvě, je namístě předat pacienta do péče specializovaných center biologické léčby, kde je možné zahájit léčbu modernějšími a účinnějšími léčebnými metodami, mezi které řadíme apremilast a zejména biologika.
Apremilast
Pokud u pacientů se středně těžkou až těžkou formou psoriázy selhala fototerapie a terapie methotrexátem není účinná či je kontraindikována, je možné zahájit léčbu apremilastem. Jedná se o nový lék řazený do kategorie tzv. malých molekul. Jeho malá molekulová váha umožňuje snadný průnik přes cytoplazmatickou membránu s následným ovlivněním intracelulárních signálních pochodů. Mechanismus účinku apremilastu spočívá v inhibici fosfodiesterázy 4 (PDE-4). Díky inhibici PDE-4 dochází k modulaci exprese tumor nekrotizujícího faktoru alfa, interleukinu 23 a 17 a jiných zánětlivých cytokinů. Výhodou malé molekulové váhy ve srovnání s biologiky je možnost perorálního podávání. Nejčastějšími nežádoucími účinky terapie bývají gastrointestinální potíže (nauzea, zvracení, průjem), které se vyskytují většinou na začátku léčby. Z tohoto důvodu se dávka apremilastu po dobu prvního týdne postupně navyšuje až na udržovací dávku 30 mg 2× denně (21).
Biologická terapie
Biologická terapie je indikována k léčbě závažné formy psoriázy, definované hodnotami PASI > 10,0. Současně je nutné, aby pacient absolvoval minimálně dvě formy systémové terapie ze čtyř (cyklosporin, methotrexát, acitretin, fototerapie), respektive z pěti (u některých novějších typů biologik je mezi konvenční metody systémové terapie zařazen i apremilast), které nevedly k dostatečné terapeutické odezvě. Výjimkou jsou případy, kdy je systémová konvenční terapie kontraindikována nebo vedlejší účinky neumožnily její pokračování.
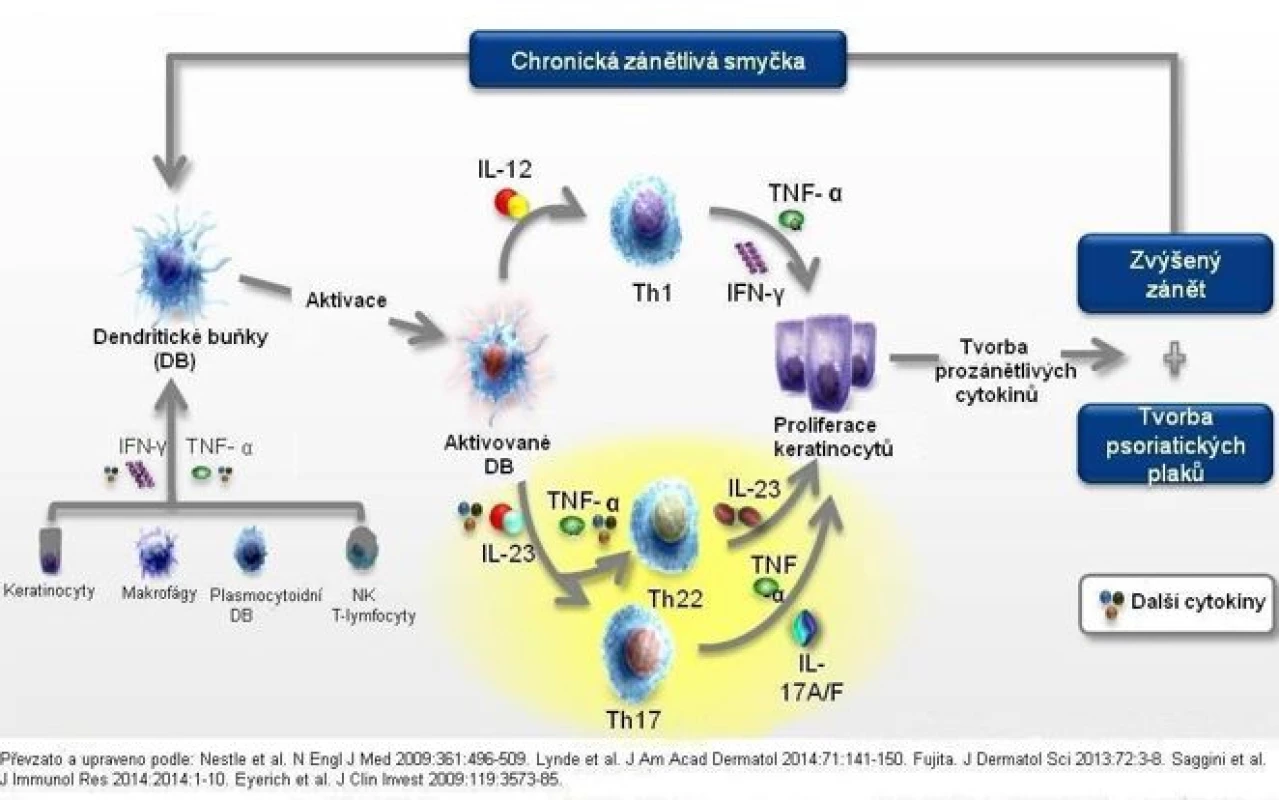
Biologické léky jsou biotechnologickým postupem vyráběné přípravky, které cíleně modifikují biologickou odpověď na molekulární úrovni. V patogenezi psoriázy hrají klíčovou roli T lymfocyty a jejich zprostředkováním následně celá řada cytokinů. Jejich aktivace zatím blíže neznámým antigenem vede ke kaskádě procesů, jejichž výsledkem je produkce řady prozánětlivých cytokinů. V některých případech může být zánětlivý proces spuštěn i prostřednictvím faktorů nespecifické imunity (obr. 5).
Mezi stěžejní cytokiny, které jsou inhibovány prostřednictvím cílené biologické léčby, řadíme zejména tumor nekrotizující faktor alfa (TNFα), interleukin 17 (IL-17) a interleukin 23 (IL-23; 22, 23). V souvislosti s odlišným mechanismem účinku se liší i dávkovací schéma jednotlivých preparátů (tab. 2).
Tab. 2: Dávkovací schéma biologické léčby u dospělých (dle SPC jednotlivých přípravků)
Biologikum Aplikace v iniciační fázi Aplikace v udržovací fázi infliximab
5 mg/kg v týdnu 0, 2 a 6
5 mg/kg à 8 týdnů
adalimumab
80 mg v týdnu 0 a 40 mg v týdnu 1
40 mg à 2 týdny
certolizumab-pegol
400 mg v týdnu 0, 2 a 4
200 mg à 2 týdny
etanercept
shodná s udržovací fází
50 mg à 1 týden
ustekinumab
45 mg v týdnu 0 a 4*
45 mg à 12 týdnů*
secukinumab
300 mg v týdnu 0, 1, 2, 3 a 4
300 mg à 4 týdny
ixekizumab
160 mg v týdnu 0; 80 mg v týdnu 2, 4, 6, 8, 10, 12
80 mg à 4 týdny
brodalumab
210 mg v týdnu 0, 1 a 2
210 mg à 2 týdny
guselkumab
100 mg v týdnu 0 a 4
100 mg à 8 týdnů
* Uvedené dávkovací schéma ustekinumabu platí pro osoby s tělesnou hmotností 60–100 kg. Pacienti s vyšší hmotností aplikují ve stejných intervalech dvojnásobnou dávku (90 mg).
Biologika namířená proti TNFα jsou v indikaci léčby psoriázy nejdéle používanými preparáty. Do této skupiny řadíme protilátky proti TNFα (infliximab, adalimumab a certolizumab-pegol) a fúzní protein, který funguje jako neutralizační receptor pro TNFα – etanercept.
Infliximab je chimerická monoklonální protilátka proti TNFα, která obsahuje 75 % humánní a 25 % myší komponenty. Biologikum je podáváno v podobě intravenózní infuze, dávka léku závisí na hmotnosti pacienta a v udržovací fázi se aplikuje 1× za 8 týdnů (tab. 2). Biologický poločas je cca 8 dní (24).
Adalimumab je rekombinantní plně humánní protilátka proti TNFα. V udržovací fázi se adalimumab aplikuje subkutánně 1× za 2 týdny a biologický poločas činí v průměru 14 dnů. Adalimumab nachází v dermatologii kromě psoriázy využití také v léčbě hidradenitis suppurativa (25).
Léčba certolizumab-pegolem byla dlouhou dobu vyhrazena pouze pro revmatologická onemocnění (revmatoidní artritida, axiální spondylartritida, ankylozující spondylitida), v roce 2018 byla indikační kritéria rozšířena i o diagnózu psoriázy. Certolizumab-pegol je rekombinantní humanizovaný Fab fragment monoklonální protilátky proti TNFα. Je tvořen pouze jednou Fab částí imunoglobulinové molekuly, která je navázána na polyethylenglykol. Vazba na polyethylenglykol prodlužuje biologický poločas protilátky a snižuje její imunogenicitu. Polyethylenglykol navíc snižuje průchod látky přes placentu, a proto je možno certolizumab v nevyhnutelných případech podávat i v graviditě. Dávkovací schéma v udržovací fázi i biologický poločas je obdobný jako u adalimumabu (26).
Etanercept je solubilní fúzní protein, který váže TNFα. Na rozdíl od protilátek proti TNFα neváže komplex TNFα a etanerceptu komplement, takže nedochází k lýze buňky, a nemůže tak dojít k rozpadu granulomů. Etanercept se aplikuje v podobě subkutánních injekcí 1× týdně a biologický poločas je 3–5 dní (27).
Ustekinumab je plně humánní monoklonální protilátka proti interleukinu 12/23, v udržovací fázi se aplikuje 1× za 12 týdnů subkutánně a biologický poločas je 15–32 dní (28).
Další velkou skupinou biologik jsou přípravky namířené proti interleukinu 17, který je klíčovým efektorovým cytokinem v patogenezi psoriázy (29). Do této skupiny řadíme secukinumab, ixekizumab a brodalumab.
Secukinumab je plně humánní monoklonální protilátka, která selektivně váže a neutralizuje prozánětlivý cytokin IL-17. V udržovací fázi se aplikuje subkutánně 1× za 4 týdny. Biologický poločas je 27 dní (30).
Ixekizumab je chimerická monoklonální protilátka, která se s vysokou afinitou a specifitou váže na interleukin 17. Schéma aplikace v udržovací fázi je shodné jako u secukinumabu, tedy subkutánně 1× za 4 týdny. Biologický poločas je 13 dní (31).
Nejnověji je na našem trhu ze skupiny inhibitorů IL-17 dostupný brodalumab. Jedná se o plně humánní protilátku, která selektivně váže a neutralizuje receptor pro IL-17, čímž blokuje biologickou aktivitu prozánětlivých cytokinů IL-17A, IL-17F, IL-17A/F a IL-25. Doporučená dávka v udržovací fázi terapie je 210 mg subkutánně 1× za 2 týdny. Biologický poločas je 11 dní (32).
Nejnovější skupinu biologických preparátů určených pro léčbu psoriázy představují inhibitory IL-23, který je klíčovým iniciačním cytokinem v patogenezi psoriázy. V této kategorii je v ČR registrován zatím jeden preparát – guselkumab. Jedná se o humánní protilátku namířenou proti IL-23, doporučená aplikace je subkutánně 1× za 8 týdnů. Biologický poločas je 15–18 dní (33).
Díky nejnovějším skupinám biologických preparátů (zasahujících do osy IL-23/17) se nám ve velké většině případů daří zajistit výbornou terapeutickou odezvu s dosažením PASI 90 až PASI 100 s korelujícím významným zlepšením kvality života a dosažením nulových hodnot DLQI. Velkou výhodou většiny biologických léčiv je kromě vysoké pravděpodobnosti dosažení terapeutického cíle také rychlý nástup účinku, který shrnuje obrázek č. 6.
Obr. 6. Rychlost nástupu účinku biologických léčiv (34, 35) 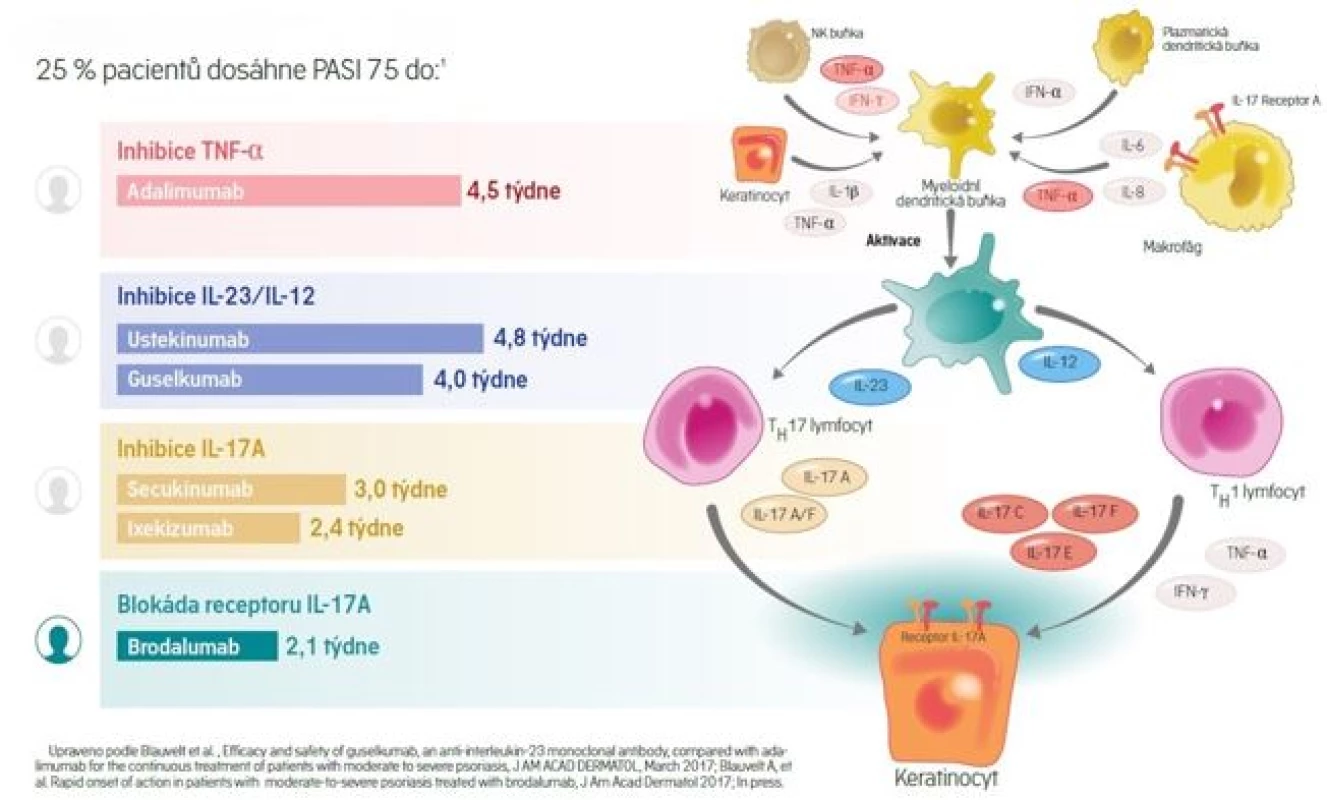
Biologická léčba u specifických skupin pacientů
Díky odlišnému mechanismu účinku jednotlivých biologik se i jejich použití v rámci terapie psoriázy mírně liší. Pro artropatické formy psoriázy prokazují velmi dobrou účinnost anti-TNFα preparáty a inhibitory IL-17. U pacientů s přidruženými nespecifickými střevními záněty je v současné době nejvhodnější volbou infliximab, adalimumab nebo ustekinumab. Zatímco aktivní tuberkulóza je striktní kontraindikací pro podání biologické léčby, u latentní tuberkulózy je možné po 2 měsících profylaktické léčby isoniazidem (celková délka profylaxe je 6 měsíců) zahájit léčbu kterýmkoliv biologickým preparátem. Nejméně vhodné jsou z pohledu potenciálního rizika vzplanutí TBC infekce infliximab a adalimumab (36). U pacientů s asociovanou hepatitidou C je preference přípravků podobná jako u latentní TBC. U pacientů s přidruženou hepatitidou B je biologická léčba kontraindikována (37).
Očkování pomocí živých oslabených vakcín není obecně vhodné u imunosuprimovaných pacientů, mohlo by totiž dojít k rozvoji choroby, proti které se imunizuje. Ostatní typy vakcín nejsou kontraindikovány, ale není zaručeno, že vyvolají dostatečnou imunitní odezvu.
Biologická terapie nevykazuje teratogenní či embryotoxické účinky, i tak se ale v případě psoriázy většinou nedoporučuje pokračovat v terapii v průběhu těhotenství ani při kojení. V nevyhnutelných případech je dnes pro terapii psoriázy v graviditě nejvhodnější certolizumab-pegol (38).
Biologická léčba může zhoršovat hojení ran v důsledku vyššího rizika rozvoje hlubokých i povrchových infekcí v místě rány, a proto se doporučuje před plánovanými chirurgickými výkony terapii na přechodnou dobu přerušit. Přerušit terapii je potřeba i při rozvoji závažnějšího infekčního onemocnění, v graviditě či před plánovaným očkováním živými oslabenými vakcínami. Doba nutná k dostatečné eliminaci léku z organismu závisí na biologickém poločase daného léku (tab. 3). U drobných chirurgických zákroků není nutné biologickou terapii přerušovat.
V případech rozvoje onkologického onemocnění je nutné biologickou terapii ukončit. Opětovné zahájení terapie je na základě typu malignity a dle stabilizace onkologického onemocnění velmi individuální. Vždy je nutná konzultace onkologa a jeho souhlas se zahájením léčby. Preferovanou variantou systémové léčby je u pacientů s onkologickou anamnézou apremilast, eventuálně preparáty zasahující do osy IL-23/17 (39, 40).
Tab. 3: Biologický poločas jednotlivých biologik (dle SPC jednotlivých přípravků)
Biologikum
Biologický poločas
infliximab
8 dní
adalimumab
14 dní
certolizumab-pegol
14 dní
etanercept
3–5 dní
ustekinumab
15–18 dní
secukinumab
27 dní
ixekizumab
13 dní
brodalumab
10 dní
guselkumab
15–18 dní
Management léčby
Možnosti terapie psoriázy jsou v současné době velmi rozsáhlé. Při volbě adekvátního postupu léčby je proto potřeba zohlednit nejen rozsah a závažnost onemocnění, ale také psychosociální aspekty onemocnění. V některých případech i malý rozsah onemocnění výrazně zhoršuje kvalitu života pacienta. Proto je nutné ke každému pacientovi přistupovat individuálně, léčbu volit po vzájemné domluvě s pacientem a zohlednit nejen benefit terapie, ale i její potenciální rizika.
Vzhledem k relativně malému počtu specializovaných center pro biologickou léčbu psoriázy a naopak většímu množství spádových dermatologických ambulancí je nutné, aby do komplexní péče o nemocné s psoriázou bylo zapojeno široké spektrum pracovišť. Pro pacienta z tohoto postupu plyne celá řada výhod – je sledován stále stejným lékařem, čímž je zachována kontinuita péče, cestovní náklady jsou pro pacienta minimální, stejně jako časová náročnost spojená s vyšetřením. Nedochází tak ke zbytečnému prodlení a pacient je léčen adekvátní terapií dle stupně postižení. V případě vyčerpání možností terapie je vhodné odeslat pacienta s kompletní dokumentací do specializovaných center pro biologickou léčbu.
U pacientů, kteří nemohou být léčeni systémovou konvenční terapií z důvodu komorbidit, je vhodné doplnit vyšetření příslušným specialistou, aby bylo zřejmé, že se jedná o zásadní kontraindikaci systémové terapie. Pakliže pacient kritéria splňuje, měla by být po předchozím komplexním vyšetření v rámci specializovaného centra pro biologickou léčbu bez zbytečných průtahů zahájena biologická terapie.
Dobrá spolupráce regionálních pracovišť s centrem pro biologickou léčbu psoriázy je klíčem k co nejrychlejšímu nastavení optimální terapie, která umožní dostat průběh onemocnění pod kontrolu.
Závěr
Psoriáza je chronické zánětlivé onemocnění kůže s významným dopadem na kvalitu života nemocných, u těžkých případů s invalidizujícím průběhem, zvýšeným rizikem kardiovaskulárních onemocnění a dalších komorbidit. Přístup k pacientům s psoriázou musí být proto vždy individualizovaný a je nutné vždy přihlédnout k závažnosti choroby, její klinické formě a k dopadům na kvalitu života nemocného. Dostupnými terapeutickými metodami je možné v dnešní době účinně kontrolovat průběh onemocnění a významně zlepšit kvalitu života pacientů. Zevní terapie je dostačující u cca 2/3 pacientů s psoriázou, 1/3 pacientů je nutné léčit systémovou léčbou, která je ale bohužel stále nedostatečně využívána. Velká část pacientů tak stále nemá adekvátní terapii. Z tohoto pohledu je zásadní zejména úloha spádových dermatologů, kteří jsou často prvními, již pacienta s lupénkou diagnostikují a léčí. Je velmi žádoucí, aby regionální dermatologická pracoviště v indikovaných případech plně využívala možnosti konvenční systémové terapie. V opačném případě je výsledkem situace, kdy je pacient, který by měl být léčen systémovou terapií, dlouhodobě „podléčen“. Přetrvávající aktivita choroby pacienta zásadně stigmatizuje, může vést ke ztrátě zaměstnání a významně ovlivňuje jeho společenský život. S délkou trvání a intenzitou aktivity onemocnění také roste riziko rozvoje celé řady komorbidit (kardiovaskulární onemocnění, psychiatrické choroby, metabolický syndrom; 41). Rychlá a účinná terapie je tak pro pacienty s těžkými formami choroby zásadní.
Vrcholem terapeutických možností psoriázy je biologická léčba. Díky neustále pokračujícímu vývoji máme k dispozici již celou řadu různých preparátů s odlišným mechanismem účinku. S rozšiřujícím se spektrem moderních a stále účinnějších biologik se otevírá i otázka aktualizace terapeutických cílů u psoriázy, kdy dosažení úplné remise v podobě PASI 90–100 je stále reálnější u vysokého procenta pacientů. Včasná cílená léčba u těžkých forem psoriázy, které začínají již v mladém věku, může navíc pravděpodobně dle výsledků mnohých metaanalýz snížit riziko rozvoje výše uvedených komorbidit (42).
Seznam literatury:
- Springate D. A., Parisi R., Kontopantelis E. et al. Incidence, prevalence and mortality of patients with psoriasis: a U.K. population-based cohort study. Br J Dermatol. 2017 Mar; 176 (3): 650–658.
- Gooderham M., Debarre J. M., Keddy-Grant J. et al. Safety and efficacy of calcipotriol plus betamethasone dipropionate gel in the treatment of scalp psoriasis in adolescents 12-17 years of age. Br J Dermatol. 2014; 171 (6): 1470–7.
- Gutknecht M., Schaarschmidt M. L., Danner M. et al. Measuring the importance of health domains in psoriasis – discrete choice experiment versus rating scales. Patient Prefer Adherence. 2018 Mar 15; 12 : 363–373.
- Mrowietz U., de Jong E. M., Kragballe K. et al. A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 2014 Apr; 28 (4): 438–53; doi: 10.1111/jdv.12118. Epub 2013 Feb 26.
- Lovato P., Norsgaard H., Tokura Y. et al. Calcipotriol and betamethasone dipropionate exert additive inhibitory effects on the cytokine expression of inflammatory dendritic cell-Th17 cell axis in psoriasis. J Dermatol Sci. 2016 Mar; 81 (3): 153–64; doi: 10.1016/j.jdermsci.2015.12.009. Epub 2015 Dec 23.
- Viktorinová M. Přehled lokálních kortikosteroidů v dermatologii 2. Rozdělení lokálních kortikosteroidů registrovaných v ČR podle terapeutické účinnosti. Dermatol. pro praxi 2010; 4 (2): 78–82.
- Piaserico S., Manfredini S., Borghi A. et al. How to improve adherence to treatment in patients with mild-to-moderate psoriasis. G Ital Dermatol Venereol. 2018 Oct; 153 (5): 692–697; doi: 10.23736/S0392-0488.17.05697-8. Epub 2017 Jul 11.
- Yun Y., Ko Y., Ahn J. H. et al. Topical application of Jaungo in atopic dermatitis patients: study protocol for a randomized, controlled trial. Trials. 2017 Apr 12; 18 (1): 176.
- Gisondi P., Cassano N., Vena G. et al. La “Cross Unit”, una nuova modalità per ottimizzare il trattamento topico della psoriasi. G Ital Dermatol Venereol2014. Vol. 149 – Suppl. 1 al N. 4 : 3–7.
- Ditrichová D. Návrat k dehtovým externům. Dermatol. pro praxi 2014; 8 (4): 138–139.
- Vojáčková N. Lokální léčba psoriázy. Dermatol. pro praxi 2017; 11 (4): 174–176.
- Nast A., Gisondi P., Ormerod A. D. et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris – Update 2015 – Long version – EDF in cooperation with EADV and IPC. J Eur Acad Dermatol Venereol. 2015 Dec; 29 (12): 2277–94; doi: 10.1111/jdv.13354. Epub 2015 Oct 19.
- Ettler K. Fototerapie v dermatologii. Dermatol. pro praxi 2014; 8 (4): 144–148.
- Menter A., Korman N. J., Elmets C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 5. Guidelines of care for the treatment of psoriasis with phototherapy and photochemotherapy. J Am Acad Dermatol. 2010 Jan; 62 (1): 114–35.
- Feldman S. R., Koo J. Y., Menter A. et al. Decision points for the initiation of systemic treatment for psoriasis. J Am Acad Dermatol. 2005 Jul; 53 (1): 101–7.
- Menter A., Korman N. J., Elmets C. A. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. J Am Acad Dermatol. 2009 Sep; 61 (3): 451–85.
- Cetkovská P., Kojanová M., Arenberger P. et al. Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy. Čes.-slov. derm., 92, 2017, No. 1, p. 3–16.
- Sandimmun Neoral 100 mg kapsle, souhrn údajů o přípravku, datum poslední revize textu 11. 7. 2015.
- Neotigason 25 mg kapsle, souhrn údajů o přípravku, datum poslední revize textu 24. 10. 2018.
- Trexan 2,5 mg tablety, souhrn údajů o přípravku, datum poslední revize textu 11. 4. 2016.
- Otezla 30 mg tablety, souhrn údajů o přípravku, datum poslední revize textu 2. 8. 2018.
- Nestle F. O., Kaplan D. H., Barker J. Psoriasis. N Engl J Med. 2009 Jul 30; 361 (5): 496–509.
- Baker K. F., Isaacs J. D. Novel therapies for immune-mediated inflammatory diseases: What can we learn from their use in rheumatoid arthritis, spondyloarthritis, systemic lupus erythematosus, psoriasis, Crohn’s disease and ulcerative colitis? Ann Rheum Dis. 2018 Feb; 77 (2): 175–187.
- Remicade 100 mg, prášek pro koncentrát, souhrn údajů o přípravku, datum poslední revize textu 12. 7. 2018.
- Humira 40 mg, injekční roztok v předplněném peru, souhrn údajů o přípravku, datum poslední revize textu 26. 7. 2018.
- Cimzia 200 mg, injekční roztok v předplněném peru, souhrn údajů o přípravku, datum poslední revize textu 19. 7. 2018.
- Enbrel 50 mg, injekční roztok v předplněném peru, souhrn údajů o přípravku, datum poslední revize textu 30. 7. 2018.
- Stelara 45 mg, injekční roztok v předplněné injekční stříkačce, souhrn údajů o přípravku, datum poslední revize textu 18. 9. 2018.
- Brembilla N. C., Senra L., Boehncke W. H. The IL-17 Family of Cytokines in Psoriasis: IL-17A and Beyond. Front Immunol. 2018 Aug 2; 9 : 1682.
- Cosentyx 150 mg, injekční roztok v předplněném peru, souhrn údajů o přípravku, datum poslední revize textu 23. 10. 2018.
- Taltz 80 mg, injekční roztok v předplněném peru, souhrn údajů o přípravku, datum poslední revize textu 19. 4. 2018.
- Kyntheum 210 mg, injekční roztok v předplněné injekční stříkačce, souhrn údajů o přípravku, datum poslední revize textu 12. 9. 2017.
- Tremfya 100 mg, injekční roztok v předplněné injekční stříkačce, souhrn údajů o přípravku, datum poslední revize textu 12. 10. 2018.
- Blauvelt A., Papp K. A., Griffiths C. E. et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis: Results from the phase III, double-blinded, placebo - and active comparator-controlled VOYAGE 1 trial. J Am Acad Dermatol. 2017 Mar; 76 (3): 405–417.
- Blauvelt A., Papp K. A., Lebwohl M. G. et al. Rapid onset of action in patients with moderate-to-severe psoriasis treated with brodalumab: A pooled analysis of data from two phase 3 randomized clinical trials (AMAGINE-2 and AMAGINE-3). J Am Acad Dermatol. 2017 Aug; 77 (2): 372–374.
- Xie X., Li F., Chen J. W., Wang J. Risk of tuberculosis infection in anti-TNF-α biological therapy: from bench to bedside. J Microbiol Immunol Infect. 2014 Aug; 47 (4): 268–74.
- Snast I., Atzmony L., Braun M. et al. Risk for hepatitis B and C virus reactivation in patients with psoriasis on biologic therapies: A retrospective cohort study and systematic review of the literature. J Am Acad Dermatol. 2017 Jul; 77 (1): 88–97.
- Kaushik S. B., Lebwohl M. G. Psoriasis: Which therapy for which patient: Focus on special populations and chronic infections. J Am Acad Dermatol.2019 Jan; 80 (1): 43–53.
- Domash E. D., Abuabara K., Shin E. B. et al. The risk of infection and malignancy with TNF antagonists in adults with psoriatic disease: a systematic review and meta-analysis of RCT. J am Acad Dermatol 2011, 64 : 1035–1050.
- Haynes K., Beukelman T., Curtis J. R., et al. TNF inhibitor therapy and cancer risk in chronic immune-mediated diseases. Arthritis Rheum 2013, 65 : 48–58.
- Oliveira Mde F., Rocha Bde O., Duarte G. V. Psoriasis: classical and emerging comorbidities. An Bras Dermatol. 2015 Jan-Feb; 90 (1): 9–20.
- Carvalho A. V., Romiti R., Souza C. D., Paschoal R. S., Milman L. M., Meneghello L. P. Psoriasis comorbidities: complications and benefits of immunobiological treatment. An Bras Dermatol. 2016.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání