-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNedostatek železa - patofyziologie a léčba
Datum publikace: 30. 9. 2018
Souhrn:
Anémie z nedostatku železa je v celosvětovém měřítku nejčastějším hematologickým onemocněním vůbec. V posledních 20 letech byly popsány základní mechanismy regulace metabolismu železa, ať již se jedná o systém regulačních proteinů IRP/IRE, či o objev hepcidinu, klíčového peptidu metabolismu železa, a mechanismů regulace jeho syntézy. Příčinou sideropenie je nejčastěji zvýšená ztráta železa z organismu, v diagnostice se uplatňuje zejména kombinace hladiny feritinu v séru a saturace transferinu. U stavů s kombinovanou poruchou metabolismu železa (např. anémie u chronických onemocnění) je třeba k odhalení sideropenie většinou použít vyšetření několika parametrů. V léčbě sideropenie se uplatňuje substituce přípravky obsahujícími železo. Parenterální podávání železa je indikováno u stavů s porušenou resorpcí Fe ze střeva, jako velmi efektivní se u těchto stavů ukazuje být podání nových přípravků s rovnoměrným postupným uvolňováním i vysokého obsahu Fe v molekule (např. Fe3+ v komplexu s karboxymaltózou). Velmi dobrá biologická využitelnost těchto přípravků by mohla být výhodná i při iniciální korekci těžké sideropenie u nemocných špatně tolerujících perorální přípravky s Fe.
KLÍČOVÁ SLOVA: anémie z nedostatku železa, metabolismus železa, diagnostika, léčba, hepcidin, parenterální přípravky s Fe.
Úvod
Anémie z nedostatku železa je nejčastějším hematologickým onemocněním a v celosvětovém měřítku nejčastější chorobou vůbec. Incidence sideropenické anémie je v našem regionu cca 5 % u mužů a 8–20 % u žen, ale v rozvojových zemích je popisován výskyt až u 30–70 % populace. Pro lidský organismus je však přinejmenším stejně nebezpečný i nadbytek železa, jenž může při delším trvání vést k ireverzibilnímu poškození zejména srdce, jater a endokrinního systému toxickým účinkem hromadícího se železa.
Metabolismus železa a jeho regulace
Železo vstřebané z trávicího traktu je dopravováno do cílových tkání v trojmocné formě především ve vazbě na transferin. Transferin se na povrchu buňky váže na transferinový receptor a celý komplex podléhá endocytóze. Při poklesu pH v endocytickém váčku dochází k uvolnění Fe, které je reduktázou Steap3 redukováno na dvojmocnou formu a následně transportováno do nitra buňky pomocí DVMT1 (transportér pro dvojmocné železo, jenž zprostředkovává i transport Fe ze střeva přes membránu střevního epitelu). Uvolněné železo se váže buď na mitochondriální feritin a je dále utilizováno v mitochondriích, nebo je ukládáno v zásobní formě feritinu [1]. Metabolismus Fe v erytroidních prekurzorech je znázorněn na obr. 1. Na přelomu 80. a 90. let minulého století byl popsán mechanismus, jakým se samotné železo podílí na regulaci objemu železa, které je přijímáno buňkou, a jaká část tohoto množství je ukládána do zásobní formy a kolik železa je k dispozici pro metabolické pochody. V nepřepisované části mRNA pro tvorbu řady proteinů uplatňujících se v metabolismu železa byla popsána konstantní sekvence nukleotidů nazvaná IRE (iron regulatory element – okrsek regulovaný železem), na niž se váže tzv. IRP1 či IRP2 (iron responsive proteins – proteiny odpovídající na železo). Vazba proteinu na regulační úsek na RNA je závislá na cytoplazmatické hladině železa v tzv. labilním poolu, vazba je pevná jen při jeho nízké hladině, při stoupající hladině Fe se vytváří kubická struktura obsahující Fe-S, která vazbě brání [2]. Přítomnost komplexu IRE s navázaným IRP v iniciální nepřepisované 5' oblasti mRNA blokuje iniciaci translace. Tímto způsobem je tlumena syntéza feritinu (zásobního proteinu pro Fe), ferroportinu (proteinu zodpovědného za transport Fe extracelulárně) či δ aminolevulát syntetázy (klíčového enzymu pro tvorbu hemu) při nedostatku Fe v organismu. Naopak přítomnost komplexu IRE/IRP v koncové 3' nepřepisované oblasti mRNA zvyšuje stabilitu RNA a tím stimuluje translaci. Takto je zvyšována tvorba transferinového receptoru (zodpovědného za přívod Fe do buňky) a divalentního transportéru kovů 1 (DVMT1, jenž Fe přenáší do nitra buňky ze střeva a rovněž transportuje do cytoplazmy Fe uvolněné z vazby na transferinový receptor) při nedostatku Fe. Při nadbytku Fe naopak stoupá tvorba feritinu a ferroportinu a snižuje se syntéza transferinového receptoru a DVMT1 [3, 4] – obr. 2.
Obr. 1. Metabolismus Fe v erytroidních prekurzorech (upraveno podle Ganze et al.). 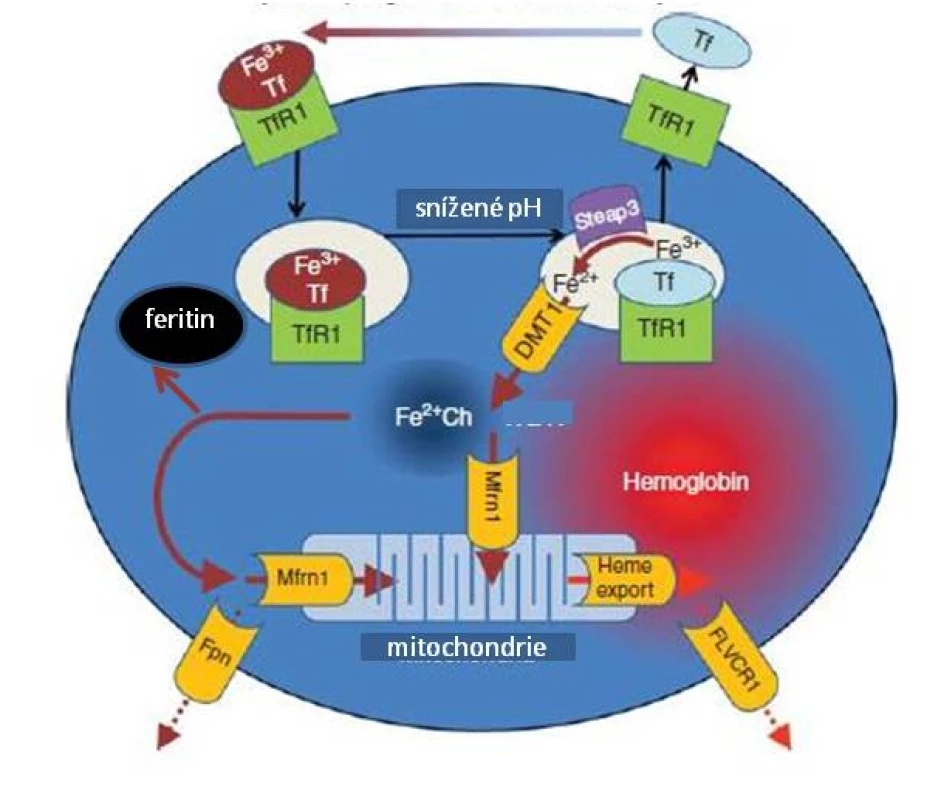
Transferin (Tf) transportující trojmocné Fe se na povrchu buňky váže na transferinový receptor 1 (TfR1), celý komplex podléhá endocytóze, v kyselém prostředí pak dochází k uvolnění Fe3+ z vazby na komplex Tf-TfR1 a jeho redukci na dvojmocnou formu účinkem reduktázy Steap3. Transport Fe2+ do nitra buňky je zprostředkován DVMT1, z intracelulárního prostoru je buď odsunováno vázané na mitochondriální feritin (Mfrn1) do mitochondrií, nebo je ukládáno do zásobní formy feritinu. Vytvořený hem je vázán s globinem. Za určitých okolností může být Fe též transportováno extracelulárně (zprostředkováno ferroportinem 1 – Fpn), stejně tak jako vznikající hem (vazbou s FLVC receptorem – FLVCR1). Obr. 2. Schéma regulace tvorby feritinu, transferinového receptoru, ferroportinu a DVMT1 hladinou nitrobuněčného železa v tzv. labilním poolu cestou vazby IRP na IRE. 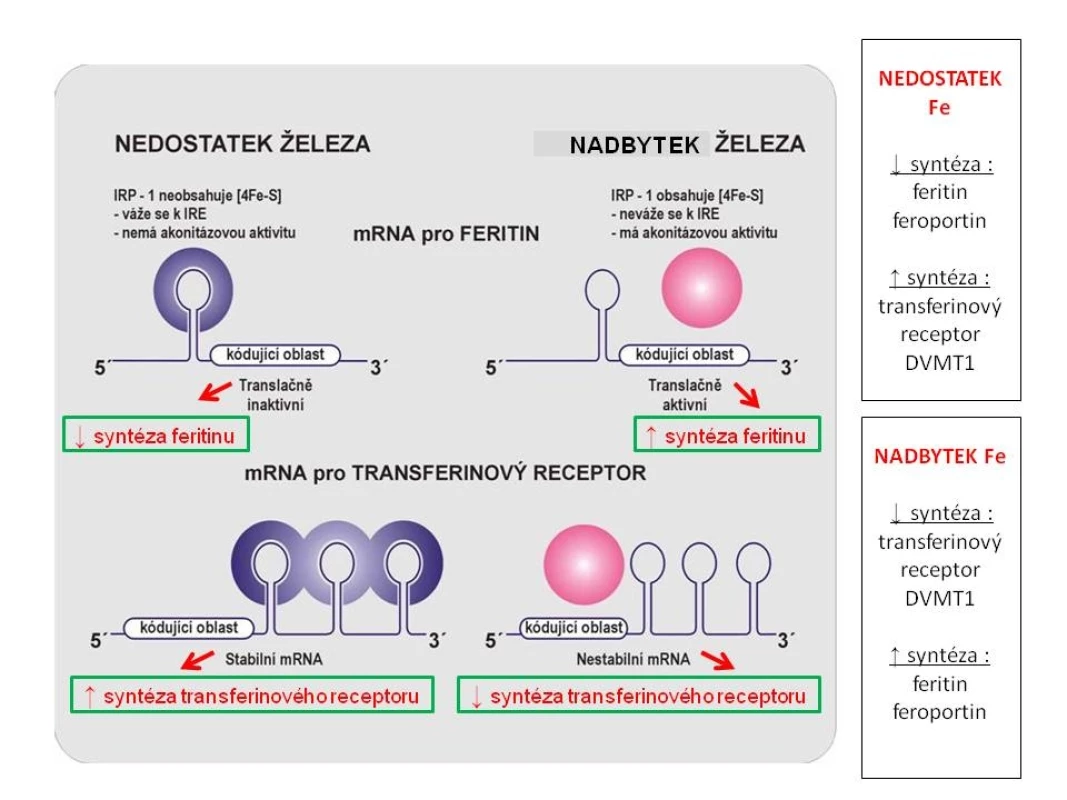
V roce 2000 byl objeven hepcidin, polypeptid syntetizovaný v játrech, jenž hraje klíčovou úlohu v regulaci metabolismu železa. Úlohou hepcidinu je degradace ferroportinu-1, jenž zprostředkovává přenos Fe extracelulárně, a důsledkem stoupající hladiny hepcidinu je tedy snížení výdeje Fe z buňky. Na regulaci tvorby hepcidinu se podílí řada faktorů, tzv. protein dědičné hemochromatózy (HH či HFE protein) se váže v buňce na transferinový receptor kompetitivně s Fe uvolněným z transferinu, volný HFE protein se váže transferinovým receptorem 2 a tento komplex indukuje tvorbu hepcidinu cestou aktivace tzv. BMP (bone morphogenic protein) receptoru a jeho signální dráhy (SMAD). V poslední době se ukazuje, že zřejmě větší regulační význam má přímá stimulace aktivity BMP receptoru proteinem BMP6 (bone morphogenic protein 6), jehož hladina je závislá na koncentraci Fe v parenchymatózních orgánech, zejména v játrech. Dalšími regulačními proteiny stimulujícími aktivitu BMP receptoru jsou hemojuvelin a matriptáza 2 (MT2 neboli TM-PRSS6). Tímto způsobem je citlivě regulován výdej železa z monocytomakrofágového systému do cirkulace a druhotně resorpce Fe ze střeva při stoupající intracelulární hladině Fe. Obdobně stimuluje tvorbu hepcidinu hemojuvelin a též zvýšená hladina některých cytokinů (IL-1, IL-6) při zánětu a tento mechanismus je základním patogenetickým momentem při rozvoji anémie při chronickém onemocnění. Anémie s hypoxií a vystupňovaná erytropoéza naopak tlumí tvorbu hepcidinu, cílem je zvýšení výdeje Fe do cirkulace za účelem přesunu do funkčního poolu v kostní dřeni a v poslední době bylo prokázáno, že tento efekt je zprostředkován proteinem nazvaným erytroferron [5], jehož sekrece zřejmě závisí na hladině endogenního erytropoetinu. Tento moment se spolupodílí na rozvoji přetížení železem u některých anémií s vystupňovanou inefektivní erytropoézou (talasémie, myelodysplastický syndrom – obr. 3). Na obr. 4 je znázorněn metabolismus Fe v monocytomakrofágovém systému po fagocytóze zanikajících erytrocytů.
Obr. 3. Přehled jednotlivých mechanismů uplatňujících se v regulaci tvorby hepcidinu. 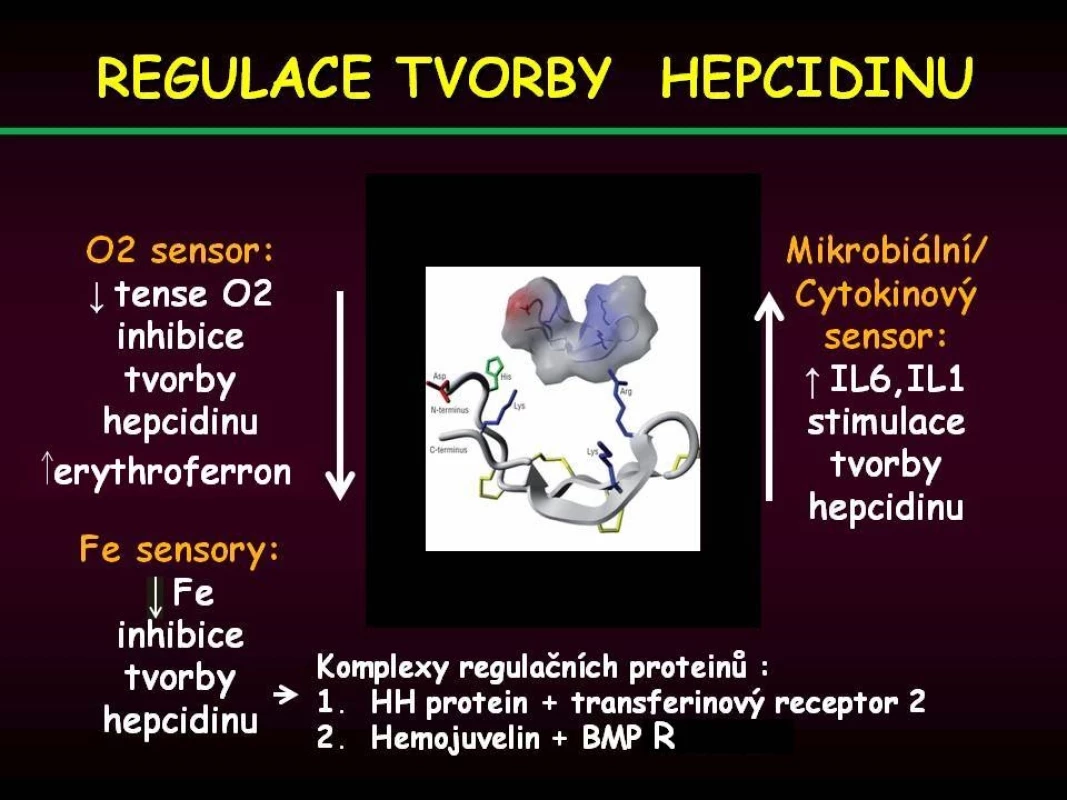
Obr. 4. Metabolismus Fe v makrofázích. 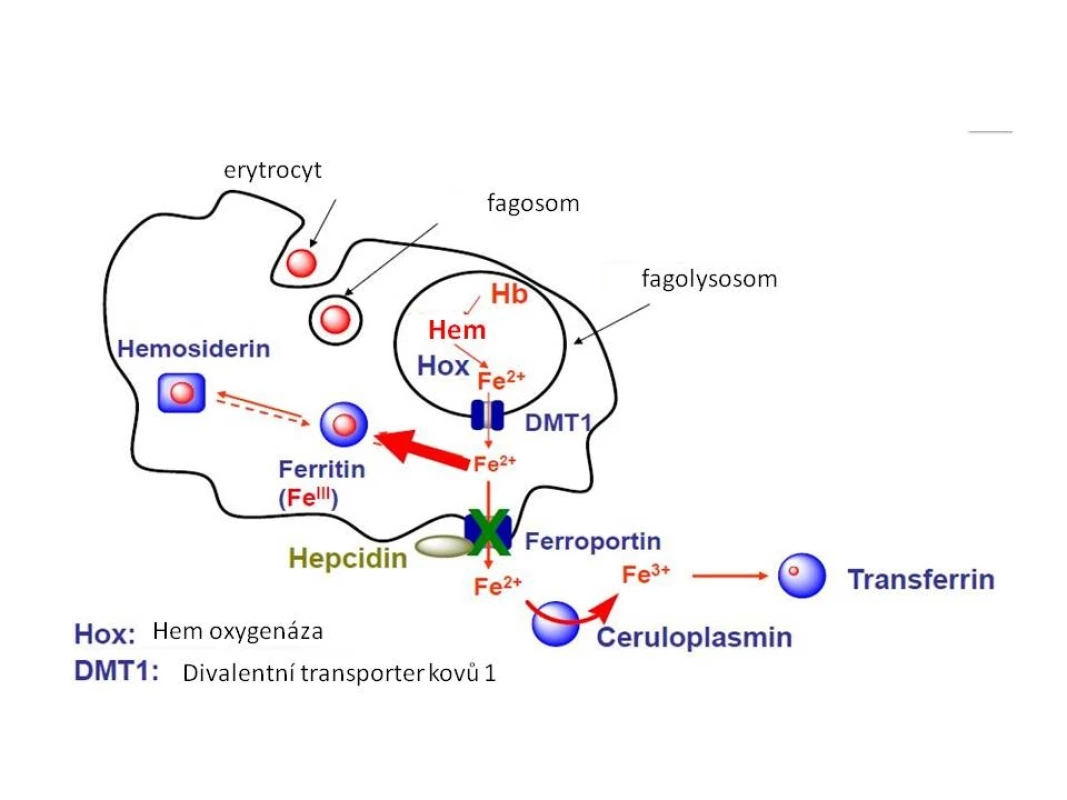
Železo z hemoglobinu fagocytovaného erytrocytu se ve fagolysozomu uvolňuje z vazby na hem účinkem hemoxygenázy (Hox) a ve dvojmocné formě je transportováno DVMT1 (DMT) do nitra buňky. Následně je buď ukládáno do zásobní formy feritinu, nebo může být transportováno extracelulárně – zprostředkováno ferroportinem 1. Aktivita ferroportinu je ovlivňována vazbou hepcidinu. Fe2+ je extracelulárně oxidováno na trojmocnou formu účinkem ceruloplazminu a může se opět vázat na transferin. Příčiny nedostatku železa
Nejčastější příčinou sideropenie jsou nadměrné ztráty železa z organismu. U žen je častým zdrojem krvácení urogenitální trakt. Během menstruace činí krevní ztráta v průměru 40–60 ml za cyklus, což odpovídá cca 16–25 mg železa. U žen se proto již fyziologicky uplatňuje prvý regulační mechanismus, kterým se organismus brání rozvoji sideropenie. Denní resorpce železa z potravy je zvýšena z 7–10 % na 20–25 % přijaté dávky. Při krevních ztrátách přesahujících 70–80 ml za cyklus však již organismus nestačí kompenzovat ztráty Fe zvýšenou resorpcí, a pokud není dostatečně zvýšen obsah Fe v potravě (z běžných 10–15 mg denně na cca 18–20 mg), dochází k postupnému rozvoji sideropenie. Značné krvácení mohou způsobit jak benigní, tak maligní nádory dělohy. Nefrolitiáza, ureterolitiáza a zánětlivé afekce ledvin a močových cest bývají méně častou, ale nezanedbatelnou příčinou chronických ztrát železa. Další častou příčinou sideropenie je krvácení do trávicího ústrojí a uplatňuje se zejména u mužů a u žen v menopauze. Z celé řady možných afekcí v GIT je nutno zdůraznit zejména peptický vřed, brániční kýlu s refluxní ezofagitidou, jícnové varixy, hemoroidy, divertikly, ale také benigní či maligní nádory. Je třeba připomenout, že krvácení do GIT mohou vyvolávat i některé léky – kyselina acetylsalicylová, glukokortikoidy, nesteroidní antirevmatika, antikoagulancia, vzácněji např. chlorid draselný. Do trávicího ústrojí mohou krvácet i nemocní s krvácivými chorobami vyvolanými poruchou funkce destiček či koagulačních faktorů. Mezi vzácnější příčiny sideropenie patří krvácení z dýchacího ústrojí a artificiální ztráty napři při hemodialýze či odběrech krve. U dárce je každý odběr krve spojen se ztrátou cca 150–200 mg železa. Nedostatečný přívod železa v potravě je v oblastech se skladbou stravy obdobnou té naší poměrně vzácný. Kromě přímého nedostatku Fe v potravě se může na jeho sníženém přívodu podílet i nadbytek látek, jež mohou inhibovat jeho resorpci (fosfáty, fytáty, tanáty, oxaláty). Častěji je nedostatečný příjem Fe projevem malabsorpce při celiakii, Crohnově chorobě či po resekci žaludku nebo střeva, kdy je omezená resorpční plocha a zrychlená pasáž potravy. U parazitárních onemocnění může jít o kombinaci porušeného vstřebávání s krvácením do GIT. Ke konsumpci Fe s jeho následným nedostatkem může vést i infekce Helicobacterem pylori.
Zvýšené nároky na přívod železa jsou přítomny v těhotenství, kdy jeho potřeba stoupá na 20–25 mg denně. Ztráta železa během gravidity se odhaduje na 900–1000 mg a zejména v posledním trimestru vzniká železem sideropenie bez substituce u více než 70 % těhotných. Během kojení činí ztráty Fe cca 1 mg denně. Zvýšená spotřeba železa je typická i pro období růstu. U dvouletých dětí by měl přívod Fe činit cca 15 mg denně, menstruující ženy mezi 14. a 30. rokem věku potřebují přibližně 18 mg železa denně. Zejména u chronických zánětlivých onemocnění střeva však může metabolismus železa ovlivňovat řada faktorů (porucha vstřebávání v GIT, krvácení do GIT, porucha distribuce Fe v organismu) a většinou je třeba použít kombinace několika laboratorních vyšetření k odhalení přítomnosti a hloubky skutečného deficitu Fe a ke správné indikaci substituční léčby – viz níže.
Nedostatek železa omezuje tvorbu fyziologicky důležitých bílkovin, ve kterých je vázáno buď ve formě hemu (hemoglobin, myoglobin, cytochromy, kataláza, peroxidáza), či v nehemové formě (akonitáza, sukcinátdehydrogenáza, xanthinoxidáza, ribonukleotidreduktáza, α-glycerolfosfátdehydrogenáza aj.). Aktivita některých enzymů (např. DNA polymerázy) je ovlivňována již výše zmíněnou kubickou strukturou obsahující Fe-S. Sideropenie se většinou rozvíjí pomalu při dlouhodobé negativní bilanci železa vznikající nepoměrem mezi chronicky zvýšenými ztrátami a nedostatečně zvýšeným množstvím Fe v přijímané potravě. Při rozvoji sideropenie rozeznáváme tři stadia. V období prelatentní sideropenie dochází k postupnému vyčerpání zásob železa, ale dodávka pro potřeby erytropoézy je ještě dostatečná. Tento stav většinou není spojen s klinickými příznaky. Ve fázi latentní sideropenie jsou zásoby Fe již zcela vyčerpány a je snížena jeho dodávka do erytroblastů kostní dřeně, avšak tento pokles zatím nelimituje proliferaci buněk. Ve stadiu manifestní sideropenie již nedostatek Fe tlumí proliferaci a vzniká obraz anémie jako důsledek neschopnosti erytropoézy kompenzovat normální či mírně zvýšený zánik erytrocytů.
Diagnostika nedostatku železa
Již v období prelatentního nedostatku železa se uplatňují kompenzační mechanismy organismu: zvýšení resorpce železa z GIT, snížení jeho výdeje a útlum tvorby feritinu – zásobního proteinu železa. Je zvýšena resorpce radioželeza (59Fe) z GIT a snížen jeho výdej močí, klesá obsah barvitelného železa v monocytomakrofágovém systému kostní dřeně a hladina feritinu v séru se snižuje pod dolní hranici normy u více než 50 % nemocných. Pro klinickou praxi je rozhodující včasná diagnostika latentní sideropenie. V této fázi je hladina feritinu v séru snížena pod 12 µg/l u více než 90 % nemocných, je snížena hladina železa v séru a zvýšena celková vazebná kapacita transferinu pro železo, saturace transferinu klesá pod 16 %. Kombinací vyšetření hladiny feritinu v séru a saturace transferinu lze odhalit až 95 % nemocných s latentní sideropenií a obě vyšetření jsou zásadní pro diagnostiku sideropenie. Současně je zvýšena koncentrace solubilních cirkulujících transferinových receptorů v séru (nad 5–8 mg/l) a koncentrace volného protoporfyrinu v erytrocytech. V kostní dřeni klesá počet sideroblastů z 50–60 % pod 30 %. Manifestní sideropenie je charakterizována hypochromií, mikrocytární anémií, hladina feritinu v séru je snížena pod 5 µg/l, saturace transferinu klesá pod 10 %, v kostní dřeni chybí zásobní Fe a nalézáme zde méně než 10 % sideroblastů.
Současně s diagnózou sideropenie je vždy nutno pátrat po příčině nedostatku železa, a nedílnou součástí vyšetřovacího postupu je proto opakované vyšetření stolice na okultní krvácení, moči a močového sedimentu, gynekologické vyšetření a event. instrumentární vyšetření GIT. V diferenciální diagnostice je třeba odlišit mírnější formy sideropenie od anémie při chronickém onemocnění a od heterozygotních forem talasémie. U nemocných s heterozygotní β-talasémií je přítomna nápadná mikrocytóza a hypochromie bez výraznější anémie, počet erytrocytů může být naopak i lehce zvýšen. Hladiny železa a feritinu v séru nejsou zvýšeny, charakteristické jsou změny v elektroforéze hemoglobinu. Vzácně je třeba odlišit kongenitální sideroblastickou anémii. U anémie při chronickém onemocnění je přítomna snížená koncentrace železa v séru v důsledku poruchy jeho distribuce v organismu a na rozdíl od pravé sideropenie není snížena hladina feritinu v séru ani saturace transferinu. Počet cirkulujících transferinových receptorů není zvýšen a je přítomna vysoká hladina hepcidinu v séru (viz tab. 1). Jak již bylo uvedeno výše, u řady chronických onemocnění, zejména u chronických zánětů střevních, však může být přítomna kombinace zvýšených ztrát Fe, jeho snížené resorpce a distribučních poruch. Snížený výdej Fe do cirkulace představuje u anémie při chronickém onemocnění (ACD) určitý obranný mechanismus bránící dodávce Fe jako růstového faktoru invadujícím mikroorganismům či nádorovým buňkám, a proto je třeba Fe do organismu dodat pouze při jeho prokázaném skutečném deficitu. Hladina feritinu bývá u ACD nespecificky zvýšena díky retenci Fe v monocytomakrofágovém systému, a proto má pro detekci přítomnosti deficitu Fe u ACD malý význam. Citlivějším ukazatelem je vyšetření hladiny cirkulujících transferinových receptorů (cTFR), její zvýšení odráží zvýšenou syntézu transferinového receptoru v buňce při nedostatku utilizovatelného železa (viz výše popsané regulační mechanismy). Ještě přesnějším je stanovení poměru hladiny cTFR k log feritinu. Průkaz zvýšené hladiny hepcidinu v séru může svědčit pro převahu distribučních změn, u stavů spojených s relativním či absolutním nedostatkem Fe je hladina hepcidinu snížena (tab. 1). V tab. 2 je uvedena doporučovaná kombinace vyšetření pro zpřesnění diagnostiky stavu zásob Fe u chronických onemocnění a jejich interpretace.
Tab. 1. Diferenciální diagnostika anémie z nedostatku železa. 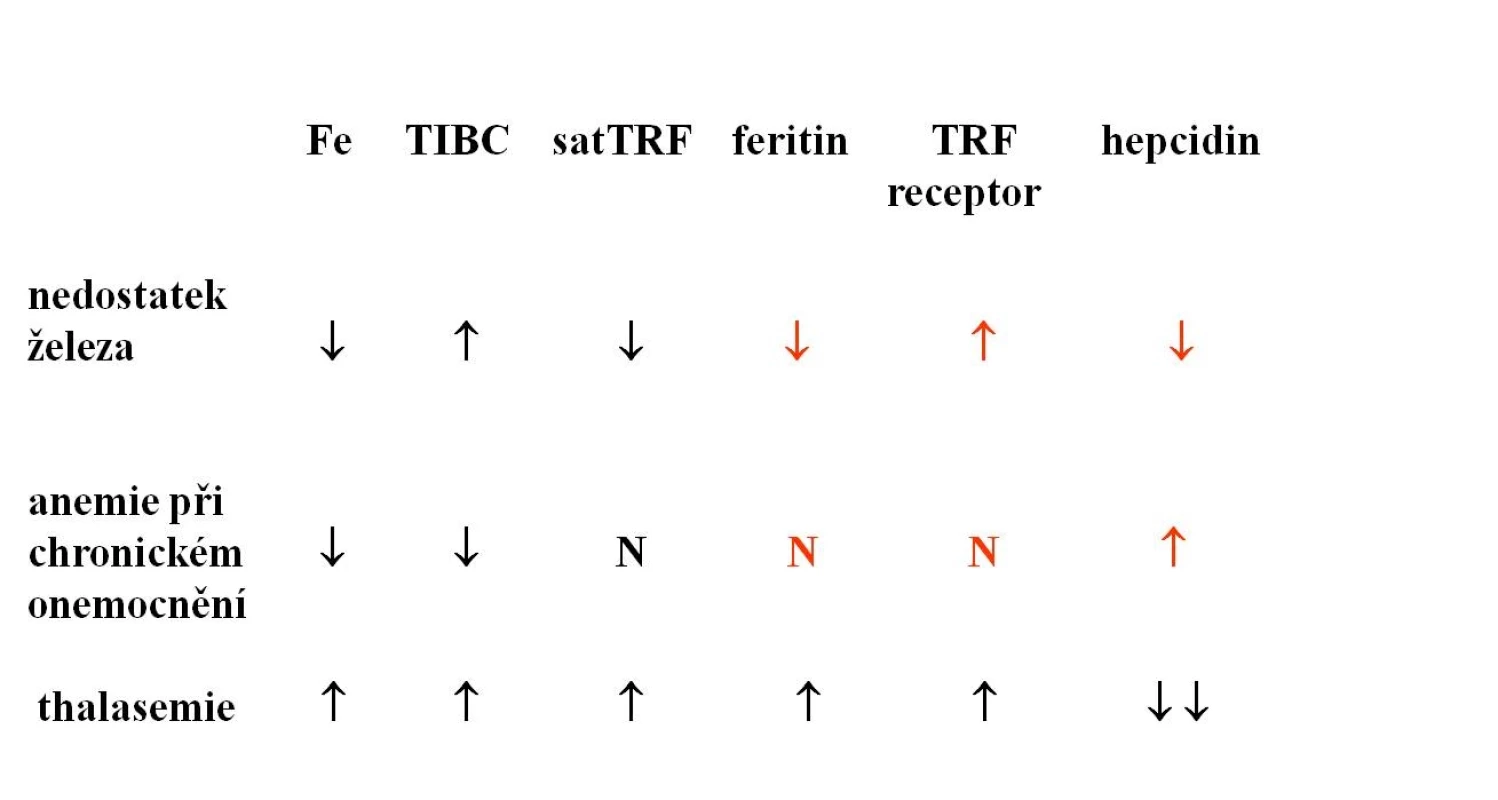
TIBC = celková vazebná kapacita transferinu pro Fe, satTRF = saturace transferinu, cTfR = cirkulující transferinový receptor. Tab. 2. Diagnostika deficitu železa u anémie při chronických onemocněních. 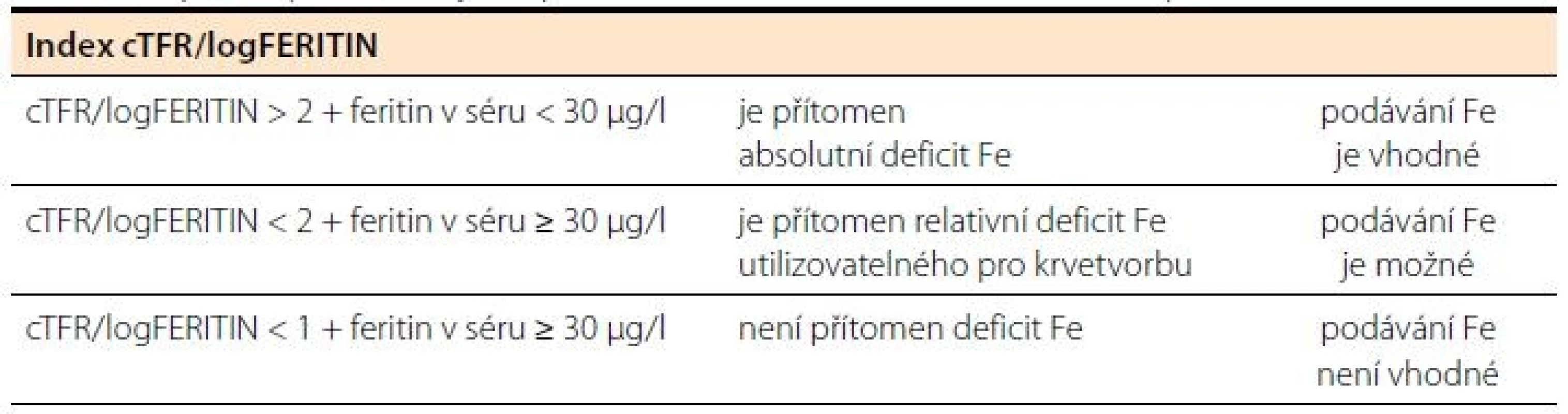
cTfR = cirkulující transferinový receptor Léčba nedostatku železa
První zásadou léčby sideropenie je odstranění její příčiny. Druhou zásadou je substituce dostatečným množstvím železa po dostatečně dlouhou dobu. Optimální léčba sideropenie by měla vést k vzestupu hodnot Hb o 2 g/l denně. K tomu je třeba vstřebat 50–60 mg elementárního Fe, což při optimální resorpci odpovídá dodávce nejméně 180–200 mg prvkového Fe denně per os. Přípravky Fe je nutno podávat rovnoměrně během dne a pokud možno na lačno, nejméně ½ hodiny před jídlem či nejméně 2 hodiny po jídle. Řada látek v potravě může snižovat resorpci Fe; naopak aminokyseliny, kyselina askorbová a citronová a některé cukry vstřebávání Fe podporují, toho je využíváno v některých přípravcích Fe. S resorpcí Fe mohou interferovat i některé léky (antacida, antagonisté H2 receptorů, pankreatická lipáza, penicilamin aj.). Přípravek Sorbifer durules obsahuje v tabletě 100 mg elementárního Fe a 60 mg kyseliny askorbové. Obdobně je v přípravku Tardyferon v tabletě 80 mg elementárního Fe vázáno s mukoproteázou, která zajišťuje jeho postupné řízené uvolňování a tím i optimalizaci resorpce. Přípravek Maltofer obsahuje v tabletě rovněž 100 mg elementárního Fe. Při špatné snášenlivosti je možno použít i tekutou formu železa v kapkách, u dětí je Fe podáváno ve formě sirupu. Podávání kombinovaných přípravků železa (většinou s vitaminem B12 a kyselinou listovou) je namístě pouze u skutečně prokázaného kombinovaného deficitu těchto látek či profylakticky v těhotenství. Různé volně prodejné přípravky obsahující kromě železa další prvky (např. Zn) a různé vitaminy nemají pro léčbu sideropenie význam kvůli malému množství Fe, jež je v tabletě obsaženo. Kontrolu účinnosti léčby provádíme v prvé fázi vyšetřením hodnot Hb, po normalizaci hodnot Hb je vhodné opakovaně kontrolovat hladinu feritinu v séru a pokračovat v léčbě do naplnění zásob Fe v organismu na optimální hodnoty, jež činí 300–500 mg, hodnota 1 µg/l feritinu v séru přitom odpovídá cca 8 mg zásobního železa.
Parenterální podávání železa je dle současných doporučení indikováno pouze u nemocných, kde je příčinou nedostatku Fe jeho malabsorpce z GIT. Běžné dávkování je 62,5 mg (Fe3+ komplex s glukonátem sodným) nebo 100 mg (Fe3+ sacharózový komplex) elementárního Fe 1× denně. Nevýhodou těchto přípravků je poměrně rychlé uvolnění železa z komplexu v cirkulaci, což může vzhledem k limitované proliferaci kvůli přítomné sideropenii snižovat jeho utilizaci. Rychlé uvolnění Fe do cirkulace je též nejčastější příčinou vedlejších nežádoucích účinků spojených s parenterálním podáním přípravků Fe. Komplex Fe3+ s karboxymaltózou umožňuje pomalé a rovnoměrné uvolňování i vysokých dávek Fe obsažených v přípravku, což je spojeno s utilizací více než 90 % podaného Fe při minimu vedlejších účinků a možnosti aplikace 1× týdně [6]. Změny metabolismu Fe u afekcí GIT mají často multifaktoriální příčinu, a jak již bylo uvedeno výše, diagnostika skutečného deficitu Fe vyžaduje většinou kombinaci několika laboratorních vyšetření. Zcela obecně a velmi zjednodušeně lze říci, že pokles hladiny feritinu v séru pod 50 µg/l a saturace transferinu pod 16–18 % může být u těchto onemocnění známkou vznikajícího absolutního deficitu Fe. Nicméně sami jsme pozorovali známky deficitu Fe při opakovaném krvácení do GIT u nemocného s ulcerózní kolitidou a chronickou jaterní lézí i při hodnotě feritinu v séru 490 µg/l, přičemž hodnota cTFR činila 12,9 mg/l a index cTFR/log feritin byl 4,45.
Z pohledu hematologa je nutno pečlivě indikovat i podávání parenterálních přípravků s Fe u nemocných s chronickou renální insuficiencí léčených rekombinantním lidským erytropoetinem (rHuEPO). Část nemocných má známky určitého stupně přetížení Fe kvůli základnímu chronickému onemocnění a opakovaným transfuzím erytrocytů. V naší studii změn zásob Fe u nemocných s chronickou renální insuficiencí léčených podáváním rHuEPO byla nutná substituce přípravky Fe již během prvého měsíce léčby jen u nemocných s iniciální hladinou feritinu v séru < 30 µg/l, u nemocných s hladinou feritinu v séru 50–100 µg/l byla substituce započata od třetího měsíce léčby a u nemocných s iniciální hodnotu feritinu v séru > 100 µg/l bylo možno substituci Fe zahájit až po prvním roce léčby, přičemž u nemocných s počáteční hladinou feritinu v séru > 750 µg/l nebylo nutno podávání přípravků s Fe třeba zahájit během 36 měsíců léčby rHuEPO vůbec a podávání samotného erytropoetinu naopak vedlo k efektivnímu snížení nadbytečných zásob Fe [7], což je zřejmě možno vysvětlit recentně popsaným inhibičním efektem erytropoetinu na tvorbu hepcidinu [5].
U řady dalších onemocnění probíhají studie možného příznivého efektu parenterálně podávaného železa, zejména na možný efekt aplikovaného Fe na funkci kardiomyocytů u kardiaků vs. díky příznivému efektu na hodnoty Hb a korekci hypoxie. Z hematologických onemocnění se jeví možnou racionální indikací podání parenterálního Fe v komplexu s karboxymaltózou těžká sideropenie s projevy anemického syndromu u nemocných, kteří velmi obtížně tolerují efektivní dávku jakéhokoli perorálního přípravku s Fe. Zde by mohlo podání přípravku s vysokým % efektivní utilizace urychlit na rozdíl od jiných parenterálních forem Fe korekci anémie a vytvoření určitého stupně zásob Fe, což by umožnilo použít v další léčbě nižší a lépe tolerované dávky perorálních přípravků s Fe.
Literatura:
- Ganz T., Nemeth E.: Iron metabolism: interactions with normal and disordered erythropoiesis. Cold Spring Harb Perspect Med 2012; 2: a011668.
- Rouault T. A. The role of iron regulatory proteins in mammalian iron homeostasis and disease. Nature Chemical Biology 2; 2006: s. 406–414.
- Roy C. N., Enns C. A.: Iron homeostasis: new tales from the krypt. Blood. 96; 2000: s. 4020–4027.
- Eisenstein R. S., Blemings K. P.: Iron Regulatory Proteins, Iron Responsive Elements and Iron Homeostasis. J. Nutr. 128; 1998: s. 2295–2298.
- Kautz L., Jung G., Valore E., Rivella S., Nemetha E., Ganz T.: The erythroid factor erythroferrone nad its role in iron homeostasis. Blood; 122, 2013 : 12; abstr. 4.
- Geisser P.: The pharmacology nad safety profile of ferric carboxymaltose (Ferriprox®): structure/reactivity relationships of iron preparations. Port J Nephrol Hypert 23; 2009, 11–16.
- Čermák J., Gregora E., Lachmanová J., Brabec V.: Sledování zásob železa u nemocných s chronickým selháním ledvin léčených rekombinantním lidským erytropoetinem. Vnitř. lék. 1994; 40: s. 174–178.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



