-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaOsteoporóza u mužů
Datum publikace: 3. 11. 2015
S prodlužující se délkou života se osteoporóza stává zdravotním, sociálním a ekonomickým problémem také u mužů. Jeden z pěti padesátiletých mužů prodělá během dalšího života nízkotraumatickou zlomeninu. U mužů je pravděpodobnost prodělání nízkotraumatické zlomeniny během života (o 13 %) vyšší než riziko karcinomu prostaty . Je však třeba uvést, že 61 % neobratlových zlomenin a 58 % zlomenin proximálního femuru vzniká u mužů, kteří mají při denzitometrickém vyšetření jen osteopenii, nikoli osteoporózu . Protože v České republice je pro úhradu léčby zvažována především osteodenzitometrická diagnóza onemocnění, je klinická diagnóza osteoporózy stanovena pozdě, a dokonce i po zlomenině je léčeno mnohem méně mužů než žen.
Vývoj skeletu u mužů
Vytváření vrcholové kostní hmoty (peak bone mass) je úzce vázáno na genetické faktory, výživu, fyzickou aktivitu a hormonální změny během puberty. U chlapců je vrcholové kostní hmoty dosaženo v průměru v 18 letech, zatímco u děvčat kolem 16. roku věku . Samotná volumetrická BMD (g/cm3) je u obou pohlaví obdobná a s věkem se podstatně nemění (graf 1). Vývoj BMD trámčité kosti je u obou pohlaví obdobný, ale vrcholová kostní hmota, měřená konvenční denzitometrií, je u mužů o 8–10 % vyšší než u žen. U mladých mužů je průřez kostí o 40 % větší než u děvčat , tloušťka kortexu je obdobná. I když je pohlavní dimorfismus skeletu komplexní, jsou to zejména androgeny, větší svalová hmota a aktivita, které stimulují periostální novotvorbu a rozšiřování průměru kosti. Kostní trámce se během puberty zesilují u chlapců, nikoli však u dívek . To vše je spojeno s významným rozdílem v mechanické odolnosti kosti, který zčásti vysvětluje nižší riziko zlomenin u mužů ve vyšším věku .
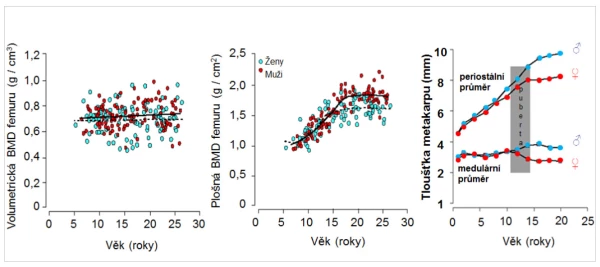
Graf 1. Závislost změn BMD a geometrie kosti na věku.
Příčiny a rizikové faktory osteoporózy a zlomenin u mužů
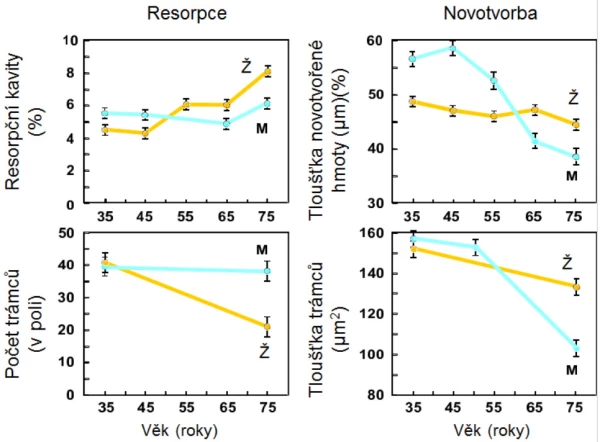
U mužů se neuplatňuje dočasně zrychlený úbytek kostní hmoty, ke kterému dochází u žen po menopauze. U zdravých mužů se již ve středním věku zvolna ztenčují kostní trámce, úbytek kortikální kostní hmoty se prokazuje kolem 65. roku . Stárnutí je také u mužů spojeno s významnými změnami množství, kvality a architektury kostí. Díky metabolickým konverzím testosteronu (graf 2) však zůstává i u starých mužů sérová koncentrace biologicky dostupného estradiolu významně vyšší než u žen po menopauze (graf 2). Estradiol upravuje remodelaci kosti a ani u starých mužů se neporušuje mikroarchitektura kosti a zejména konektivita kostních trámců tak výrazně jako u žen (graf 3). Incidence zlomenin se u mužů zvyšuje až při sérových koncentracích celkového estradiolu < 60 pmol/l (16 ng/l) . Estradiol také upravuje remodelaci endokortikální kosti a porotizaci kortexu. Pokles sérové koncentrace sexagenů u mužů v závislosti na věku (graf 4) zčásti vysvětluje nárůst endokortikální osteoresorpce a porotizace kortikální kosti s věkem. Přesto i u starších mužů pokračuje periostální apozice kostní hmoty a dalším nárůstem průměru kosti se mechanická síla kosti u mužů uchovává lépe než u žen . Po 65. roce je u obou pohlaví srovnatelná rychlost úbytku kostní hmoty s věkem i rychlost nárůstu incidence zlomenin obratlů a proximálního femuru (graf 5).
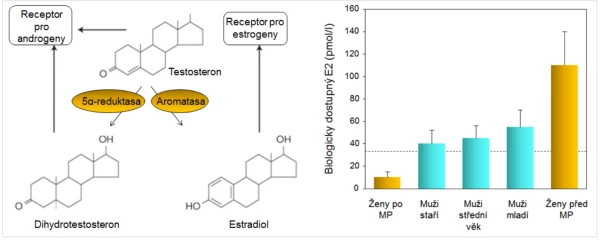
Graf 2. Metabolické konverze testosteronu a biologicky dostupný estradiol u mužů a žen.
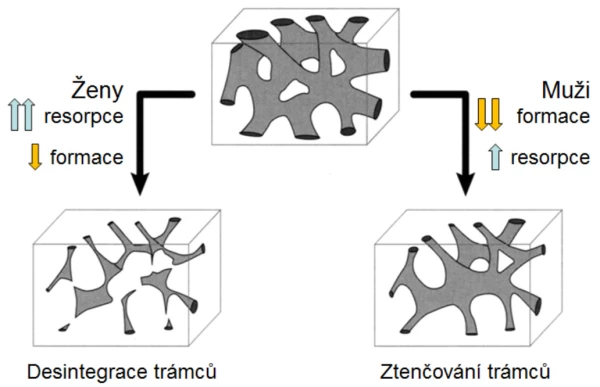
Graf 3. Změny trámčité kosti s věkem u žen a u mužů.
Graf 4. Změny sérové koncentrace sexagenů u mužů v závislosti na věku.
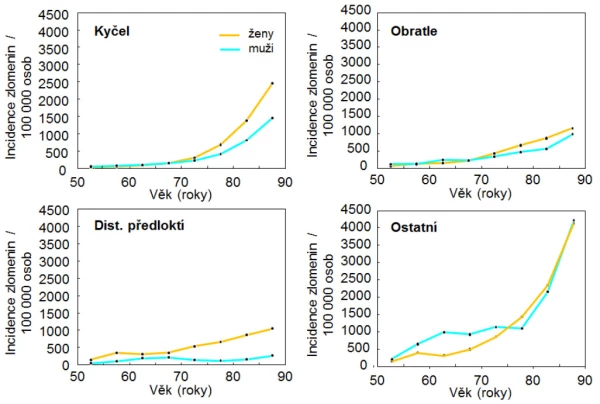
Graf 5. Incidence zlomenin u českých mužů a žen v závislosti na věku a pohlaví.
U mužů je incidence zlomenin výrazněji bimodální než u žen. U mladších mužů jsou nejčastější zlomeniny dlouhých kostí po velkém traumatu, u pacientů s idiopatickou osteoporózou a u pacientů se sekundárními rizikovými faktory zlomenin (tab. 1). U mužů starších 70 let převažují zlomeniny obratlových těl a zlomeniny v oblasti kyčle (tab. 2). Tyto zlomeniny jsou důsledkem zvýšené křehkosti kostí a dochází k nim po nepřiměřeně malém traumatu, např. po pádu ze stoje. Podobně jako u žen platí i u mužů, že čím starší pacient, tím pravděpodobněji je příčinou zlomenin zhoršování kvality kostní hmoty a zvyšování křehkosti kostí stárnutím. U těchto pacientů nejsou biochemické markery remodelace kosti zvýšené a naopak jsou hraničně nižší markery kostní novotvorby. Nízká remodelace kosti je spojena s hromaděním mikropoškození, která navozují apoptózu osteocytů a mohou snižovat mechanickou sílu kosti . Důsledkem nízké remodelace je také glykace kostního kolagenu a hromadění pentosidinu a tím zhoršování elasticity kosti.
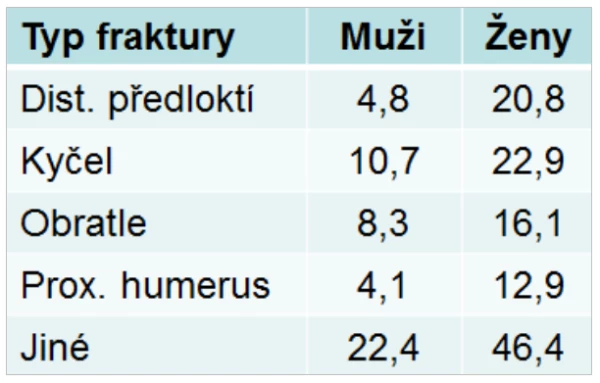
Tab 2. Pravděpodobnost prodělání zlomeniny po 50. roce (%)
Klasifikace osteoporózy u mužů
Jakkoli jsou příčiny úbytku a zhoršování kvality kostní hmoty u mužů individuálně značně rozdílné, lze je rozdělit na primární (idiopatická a involuční osteoporóza) a sekundární (tab. 1). Nejvýznamnější příčinou osteoporózy a nízkotraumatických zlomenin u mužů je stárnutí. Při involuční osteoporóze u mužů s věkem klesají sérové koncentrace sexagenů (graf 4), zvyšují se sérové koncentrace SHBG (sex-hormone binging globulin), klesá produkce růstového hormonu, IGF-1, funkce osteoblastů a kostní novotvorba (graf 6). Ke zlomeninám dochází po 70. roce věku, typicky v oblasti prox. femuru ,
Graf 6. Změny trámčité kostní hmoty v závislosti na věku.
U pacientů s idiopatickou osteoporózou chybí průkaz sekundárních příčin úbytku kostní hmoty, není to konstituční hubenost ani pozdní nástup puberty. Histomorfometricky se prokazuje snížení kostní novotvorby, jehož příčinou je dysfunkce osteoblastů . Muži s idiopatickou osteoporózou a současně hyperkalciurií však mají zvýšenou osteoresorpci . Charakteristické jsou symptomatické fraktury obratlů ve věku 30–70 let a stresové fraktury kostí končetin. Častá osteoporóza v rodinné anamnéze svědčí pro významnou úlohu genetických faktorů, ať už je to polymorfismus genu pro kolagen typu I, aromatázu, IGF-I, LRP5, nebo receptor pro vitamin D nebo estradiol .
Při sekundární osteoporóze zvyšují riziko zlomenin u mužů validované rizikové faktory. U starších mužů i žen je to zejména zvýšená resorpce kosti, navozená sekundární hyperparatyreózou při insuficienci nebo deficienci vitaminu D. Prevalence sekundárních příčin osteoporózy je u mužů vyšší než u žen. Některý z rizikových faktorů, které se podílejí na onemocnění skeletu, se prokazuje až u poloviny všech mužů s osteoporózou a nízkotraumatickými zlomeninami (tab. 1). Nejvýznamnějšími jsou abúzus alkoholu, hyperkortizolismus a hypogonadismus .
Tab. 1. Klasifikace a etiologie osteoporózy u mužů
Primární osteoporóza
Idiopatická: zlomeniny obratlů u mužů středního věku
Involuční: zlomeniny prox. femuru u mužů ≥ 70 let
Sekundární osteoporóza
Endokrinopatie
- primární a sekundární hypogonadismus (15 % mužů s osteoporózou)
- hyperkortizolismus (20 % mužů s osteoporózou)
- Diabetes mellitus I. a II. typu
- Hypertyreóza
- Primární hyperparatyreóza
- Sekundární hyperparatyreóza (insuficience a deficience vitaminu D)
Idiopatická hyperkalciurie (≥ 300 mg/24 hod.; 8 % mužů s osteoporózou)
Toxické vlivy
- alkoholismus (15 % mužů s osteoporózou)
- kouření cigaret
- těžké kovy (olovo, kadmium)
Chronická obstruktivní choroba bronchopulmonální
Chronické nefropatie s retencí dusíkatých látek (prevalence 1,8 %)
Chronická gastrointestinální onemocnění (prevalence 4,5 %)
- malabsorpce: celiakie (prevalence 1 %), zánětlivá střevní onemocnění
- primární biliární cirhóza
- stavy po gastrektomii
Chronická neuromuskulární onemocnění
Dlouhotrvající imobilizace
Stavy po transplantaci orgánů
Systémové choroby
- zánětlivá revmatická onemocnění (revmatoidní artritida, ankylozující spondylitis, systémový lupus)
- systémová mastocytóza (prevalence 3/10 000)
- mnohočetný myelom
- jiná nádorová onemocnění
Úbytek kostní hmoty navozený léky
- glukokortikoidy (> 5 mg prednizonu denně déle než 6 měsíců; prevalence 14,9 %)
- supresní léčba hormony štítné žlázy
- androgendeprivační terapie
- antikonvulziva (prevalence 1,5 %)
- některá antidiabetika, antidepresiva, antacida
- chemoterapie
Monogenní poruchy (rodinná anamnéza zlomenin)
- osteogenesis imperfecta
- Marfanův syndrom
- hypofosfátémie
- osteoporosis pseudoglioma syndrom
Dalším mimořádně důležitým faktorem nárůstu rizika zlomenin s věkem je také u mužů úbytek svalové hmoty s věkem (graf 7). Pomocí vysokorozlišující periferní QCT byla prokázána významná pozitivní korelace mezi svalovou hmotou těla a objemem a tloušťkou kostních trámců a mezi svalovou hmotou těla a tloušťkou kortikální kostní hmoty . Metaanalýza 44 studií provedených v letech 1989–2013 potvrdila význam svalové hmoty a fyzické aktivity pro prevenci úbytku kostní hmoty v populaci.
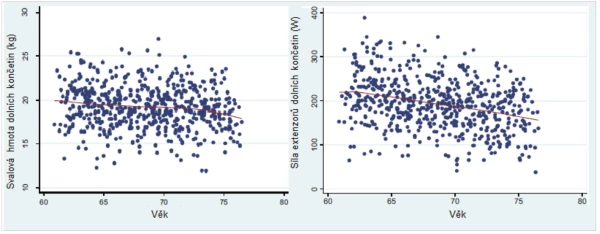
Graf 7. Sarkopenie u starších mužů.
Rozsah problému a stav v České republice
Muže postihuje každá třetí zlomenina proximálního femuru a každý pátý muž starší 50 let utrpí během dalšího života osteoporotickou zlomeninu (graf 8). U mužů narůstá s věkem incidence všech typů zlomenin, třetina zlomenin vzniká v oblasti kyčle, 20 % zlomenin v distálním předloktí, 25 % zlomenin v oblasti humeru a 42 % fraktur představují klinické zlomeniny obratlů. Většinou se jedná o nízkotraumatické fraktury.
Za rok utrpí v ČR zlomeninu kolem 28 000 mužů. Zlomeninu v oblasti kyčle utrpí přes 3 800 a zlomeninu obratle přes 4 600 z celkového počtu 1 697 000 českých mužů ve věku ≥ 50 let. Nižší prevalenci zlomenin u mužů než u žen vysvětluje kratší střední délka života, chybění zrychleného úbytku kostní hmoty, obvyklého u žen po menopauze, a větší objem kostí u mužů (graf 2). Pouze 20 % mužů má po zlomenině v oblasti kyčle uchovánu původní nezávislost na dopomoci. Po zlomenině v oblasti kyčle odchází každý druhý muž do zařízení dlouhodobé péče . Osteoporotické zlomeniny proximálního femuru i obratlů jsou asociovány se zvýšeným rizikem úmrtí v dalších 5–10 letech . Riziko úmrtí u mužů stoupá s počtem a závažností dříve prodělaných zlomenin. Ve všech věkových kategoriích je mortalita u mužů vyšší než u žen . V prvním roce po zlomenině kyčle umírá 37 % mužů a 20 % žen.
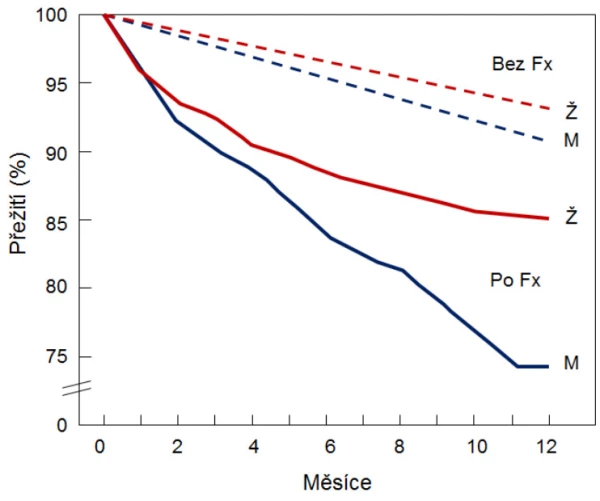
Graf 8. Pravděpodobnost úmrtí po zlomenině u starších žen a mužů.
Diagnostika a diferenciální diagnostika úbytku kostní hmoty a zlomenin
Klinická diagnóza osteoporózy u mužů má vycházet z anamnézy a klinického vyšetření doplněného hodnocením výsledku DXA, morfometrie obratlů a laboratorního vyšetření. Tato vyšetření umožní diagnostiku, diferenciální diagnostiku a klasifikaci osteoporózy. Základní klinické projevy osteoporózy (úbytek kostní hmoty), zlomeniny při nepřiměřeně nízkém traumatu a bolest kostí při nepřiměřeném zatížení se v různém stupni zjišťují i při jiných klinicky významných situacích. Některé jsou ve stáří poměrně časté (osteomalacie, Pagetova kostní choroba). Některé jsou méně časté (fibrózní dysplazie), ale mohou být závažné (osteomyelitis obratlů). Léčebné postupy při těchto onemocněních jsou zásadně odlišné od postupů při osteoporóze, a diferenciální diagnostika stavů s uvedenými klinickými projevy je proto velmi významná. Vyhledáni a včas léčeni by měli být muži s významným rizikem nízkotraumatické zlomeniny.
Anamnéza a klinické vyšetření poskytují údaje o genetické dispozici, stylu života (např. o nedostatečné fyzické aktivitě, kouření a o nedostatečné expozici slunečnímu záření), prodělaných onemocněních se vztahem ke stavu skeletu (např. resekci žaludku nebo střeva, intoleranci mléka, chronických zánětlivých onemocněních, průjmových stavech, častých nebo déletrvajících epizodách poruch menstruačního cyklu, ovariektomii) a o medikamentózní léčbě, která ovlivňuje stav a metabolismus kostní hmoty (např. užívání glukokortikoidů). Fyzikální vyšetření upozorní na Cushingův syndrom, hypogonadismus nebo hypertyreózu. Hepatomegalie svědčí o jaterním onemocnění a možné hemochromatóze. Nejvýraznějším nálezem u pacientů s pokročilou osteoporózou je dorzální kyfóza a zmenšení tělesné výšky. Dobrými ukazateli pro hodnocení pokročilosti a progrese osteoporózy jsou přesná měření výšky a rozpětí paží. Při kompresích obratlových těl se celková výška vzpřímené postavy snižuje, zatímco rozpětí paží zůstává nezměněno. Obvyklý poměr mezi rozpětím paží a výškou je 1,0 u zdravých jedinců bez přítomnosti kostní dysplazie či poruchy pojivové tkáně.
Hodnocení stupně úbytku kostní hmoty. Na základě vyšetření kostní denzity metodou dvouenergiové rentgenové absorpciometrie (DXA) je osteoporóza u mužů definována jako hodnota BMD v krčku femuru, která je ≤ −2,5 SD pod průměrnou hodnotou BMD u mladých zdravých žen. Prevalence osteopenie a osteoporózy se významně liší, použije-li se referenční databáze pro ženy nebo pro muže. V americké populaci měla v prvním případě osteoporózu 1–4 %, zatímco při použití databáze pro muže 3–6 % mužů . Protože je však pravděpodobnost zlomeniny funkcí absolutní hodnoty BMD, která je obdobná u žen i u mužů, je doporučeným referenčním standardem, podle kterého se vypočítává T-skóre u mužů, databáze pro bělošky ve věku 20–29 let (NHANES III).
V České republice trpí podle tohoto kritéria osteoporózou 103 000 českých mužů ≥ 50 let (6 %) . Ve věku ≥ 50 let má osteoporózu (podle DXA) 3× více žen než mužů. Zlomeninu však utrpí ~ 2 % žen i mužů. Riziko prodělání zlomeniny má tedy mnohem více mužů, než jak vypovídá osteodenzitometrická diagnostika osteoporózy . Výpověď osteodenzitometrického vyšetření (osteodenzitometrickou diagnózu) tedy nelze zaměnit za klinickou diagnózu osteoporózy ani ji užít k určení intervenčního prahu, nebo dokonce způsobu terapie . Pětina až třetina pacientů se zlomeninou v oblasti kyčle nemá denzitometricky prokazatelnou osteoporózu .
Osteodenzitometrické vyšetření je doporučováno u všech mužů ve věku 70 let a starších a zejména u mužů po nízkotraumatické zlomenině (vč. morfometrické deformity obratle), při onemocněních nebo léčbě navozujících úbytek kostní hmoty a před zahájením léčby glukokortikoidy a antiandrogeny. U posléze uvedené skupiny pacientů je doporučeno kontrolní měření BMD po 6 měsících léčby. V ostatních klinických situacích je opakování osteodenzitometrického vyšetření doporučeno po 1–2 letech. Výpověď rychlosti poklesu BMD proximálního femuru o riziku zlomeniny však lze vzhledem k variabilitě opakovaných měření BMD posuzovat až s odstupem desítky let a v některých studiích nebyla potvrzena .
BMD se měří dvouenergiovou rentgenovou absorpciometrií (DXA) v bederní páteři nebo v proximálním femuru. Denzitometrické vyšetření bederní páteře v předozadní projekci zpravidla postačuje pro stanovení BMD až do 60–70 let věku pacientů. Interpretaci změn BMD páteře ve vyšším věku komplikují mj. degenerativní hyperostotické změny, deformity obratlů, těžká skolióza, cévní kalcifikace, osteoartróza nebo osteomalacie. Měření BMD v místech skeletu s převážně kortikální kostní hmotou (krček femuru) zpravidla není zkresleno degenerativními změnami, jeho výpovědní hodnota však není zaměnitelná s výpovědí měření míst skeletu s převážně trámčitou strukturou. Dalšími příčinami obtížné interpretace BMD mohou být malá postava, nedávné užití kontrastní látky, scintigrafie, léčba zlatem a nesprávná referenční data. Riziko zlomenin kyčle je nejpřesněji vyjádřeno cíleným denzitometrickým vyšetřením proximálního femuru. Ultrazvuková vyšetření nenahrazují měření BMD ani nejsou doporučena pro monitorování účinnosti léčby.
Radiologické vyšetření má nezastupitelnou roli v diagnostice i v diferenciální diagnostice osteoporózy; jako důvod nízké kostní denzity u starých lidí může odhalit osteomalacii, může přispět ke zjištění mnohočetného myelomu, hyperparatyreózy (subperiostální uzurace) nebo hyperkortizolismu jako příčiny osteoporózy. Identifikace prodělaných zlomenin a zhodnocení deformit obratlových těl má prognostický význam. Zejména je třeba upozornit na klinickou výpověď zlomeniny obratle, která nejenom významně zhoršuje kvalitu života, ale je také signálem rizika dalších obratlových i neobratlových zlomenin. Po zlomenině obratle vyhledává lékařskou pomoc jen 20–40 % postižených osob. Dvě třetiny zlomenin obratlů proběhnou bez výraznějších klinických příznaků, ale jsouy jsou spojeny s vyšší morbiditou a mortalitou. Incidence zlomenin obratlů u českých mužů je obdobná jako v jiných evropských zemích (4–7 zlomenin u 1 000 mužů). Predilekčním místem pro zlomeniny obratlů jsou Th7, Th8, Th12 a L1, tedy ve vrcholu hrudní kyfózy a v oblasti Th/LS přechodu. Izolované fraktury od Th4 výše budí podezření na malignitu. Zlomeniny lze klasifikovat jako deformity mírné, střední nebo těžké (snížení výšky obratle o 20–25 %, o 25–40 % a o > 40 %). Kvantitativní morfometrie obratlů se provádí na dvou rtg. snímcích páteře v boční projekci centrovaných na Th7 a L2, kdy se po digitalizaci měří výšky obratlů Th4 až L5 a hodnotí se stupeň jejich snížení. Lze také užít morfometrického softwaru moderních osteodenzitometrů Hologic (VFA, Vertebral Fracture Assessment) anebo GE Lunar (LVA, Lateral Vertebral Assessment); takto zjištěnou mírnou deformitu obratle je však vhodné ověřit radiograficky. V indikovaných situacích mají cennou klinickou výpověď vyšetření MRI, CT a celotělová scintigrafie. Detailnější hodnocení morfologie trámčité a kortikální kosti u mužů umožňují pQCT, HRpQCT a FEA .
Laboratorní diferenciálnědiagnostická vyšetření u mužů
Testy 1. linie: krevní obraz, FW, CRP, fS-Ca a 24h U-Ca, fS-iCa, PO4, kreatinin, TSH a volný T4, glukóza, ALP, GMT, βCTX1, PINP, ALP, B-ALP, PTH, 25(OH)D, testosteron.
Testy 2. linie: S-elektroforéza sérových bílkovin (imunofixace), transglutaminázové protilátky, antiHIV protilátky, specializovaná vyšetření typu genotypizace (COL1A), biopsie z lopaty kosti kyčelní po značení tetracyklinem, ranní fS-kortizol po 1 mg dexametazonu podaného o půlnoci.
Vedoucím příznakem při diferenciální diagnostice osteopatií může být například snížení aktivity kostního izoenzymu sérové alkalické fosfatázy (hypofosfátémie), případně snížení koncentrace osteokalcinu, C - nebo N-terminálního peptidu prokolagenu I v séru při poruchách syntézy kolagenu typu I (osteogenesis imperfecta, hyperkortizolismus).
Biochemické markery kostní remodelace u pacientů s osteoporózou vypovídají o zrychleném úbytku kostní hmoty při nadměrně zvýšené osteoresorpci anebo při utlumené novotvorbě kostní hmoty. Nepřímo tak svědčí pro zvýšení rizika zlomenin . Prospektivní studie u mužů starších 65 let však nepotvrdila asociaci markerů s rizikem neobratlových zlomenin a zlomeniny kyčle, pokud se výsledky adjustovaly na BMD krčku femuru . Také prospektivní evropská studie prokázala u 487 mužů asociaci mezi zvýšením markerů remodelace kosti a zrychleným úbytkem hmory prox. femuru, ale prediktivní výpověď markerů byla nízká . Výpověď markerů je ovlivněna hojením zlomeniny. Výpověď markerů nelze u jednotlivých pacientů využít pro predikci nové zlomeniny a výpověď není směrodatná ani u pacientů s atypickými zlomeninami. Na rozdíl od kostní denzitometrie nevypovídají biochemické markery o množství kostního minerálu, a nelze jich proto užít k diagnostice osteoporózy. Hodnoty biochemických markerů vyšší než trojnásobek normy činí diagnózu osteoporózy nepravděpodobnou a naopak svědčí pro vysokoobratovou osteopatii jinou než osteoporózu. Při involuční osteoporóze nebo při osteoporóze navozené glukokortikoidy může upozornit na nadměrně utlumenou novotvorbu kosti zjištění sérové koncentrace P1NP (markeru syntézy kolagenu typu I) nebo osteokalcinu pod dolní mezí referenčních hodnot. Při normální nebo snížené koncentraci markerů remodelace kosti se s věkem riziko zlomenin také zvyšuje, i když pomaleji než při nadměrně zvýšené osteoresorpci.
Sérový 25hydroxyvitamin D se má stanovit u pacientů s podezřením na nedostatečnou expozici slunečnímu záření nebo na malabsorpci a před zahájením farmakoterapie osteoporózy. U mužů s osteoporózou je vhodné stanovení testosteronu v séru, aby se jako příčina úbytku kostní hmoty vyloučil hypogonadismus. Nemocní s koncentracemi sérového kalcia a fosfátů mimo normální hodnoty, s celkovou aktivitou sérové ALP vyšší než 2násobek horní hranice referenčních hodnot, koncentrací osteokalcinu pod dolní hranicí normy, s hodnotami TSH mimo referenční hodnoty a nemocní s nálezem paraproteinu nemají být bez dalšího vyšetření a případně konzultace se specialistou léčeni pro osteoporózu.
Hodnocení pravděpodobnosti zlomeniny podle klinických faktorů. Měření BMD metodou DXA neposkytuje informaci o kvalitě kosti. Většina zlomenin vzniká u osob, které mají jen osteopenii . Protože nikdy nebyl zjištěn práh BMD, po jehož překročení by byla zlomenina nevyhnutelná, a většina zlomenin vzniká u mužů, kteří mají významně zhoršenou kvalitu kostní hmoty, i když mají jen osteopenii , je v řadě zemí kritériem pro zahájení medikamentózní léčby prahová hodnota pravděpodobnosti zlomeniny založená na hodnocení klinických rizikových faktorů podle nástroje FRAX , který vyjadřuje individuální pravděpodobnost prodělání fraktury kyčle, případně kterékoli osteoporotické zlomeniny, během dalších 10 let . Nejde však o nástroj na diagnostiku osteoporózy. Odhad pravděpodobnosti podle FRAX vychází z incidence zlomeniny v závislosti na věku v dané geografické oblasti a individuálně se koriguje podle údajů o prodělané zlomenině, zlomenině kyčle u rodičů, užívání glukokortikoidů, diabetu mellitu, BMI, sekundární osteoporóze, revmatoidní artritis, kouření cigaret a nadměrné konzumaci alkoholu a případně BMD (http://www.shef.ac.uk/FRAX/). Výpověď nástroje FRAX u mužů je klinicky potřebná, i když pravděpodobnost zlomenin u mužů v některých studiích podhodnocuje , podle jiné studie nadhodnocuje .
Nefarmakologická opatření ke snížení rizika zlomenin, úprava modifikovatelných faktorů rizika zlomenin
Prevence osteoporózy u mužů se řídí obecnými principy zajištění optimálního vývoje skeletu během dospívání a udržení maxima kostní hmoty v dospělosti a vyšším věku. Primární prevence osteoporózy spočívá v zajištění přiměřené fyzické aktivity, přiměřeného přívodu vápníku a bílkovin v potravě, přiměřeného zásobení vitaminem D a C, ve vyloučení toxických vlivů prostředí (kouření, nadměrná konzumace alkoholu, těžké kovy, nadměrný příjem fosfátů apod.). Pokud je u dospělých mužů s osteopenií potvrzena dostatečná produkce sexagenů a nejsou přítomny další příčiny sekundární osteoporózy, nedošlo k fraktuře a není zrychlena kostní remodelace, postačuje přiměřený přívod živin, vápníku potravou a vitaminu D potravou a insolací. Pokud není dostatečné zásobení vápníkem a vitaminem D dosažitelné z přirozených zdrojů, je vhodné individuálně zvážit nutnost medikamentózní suplementace vápníkem a vitaminem D.
Tělesná hmotnost se má udržovat přiměřeně výšce postavy, protože neúměrně nízká hmotnost je rizikovým faktorem osteoporózy. Strava má být vyvážená a má obsahovat dostatek bílkovin. Vyvážená strava je zásadně doporučena také pro zajištění doporučeného příjmu vápníku. Pokud pacient pravidelně nepije mléko nebo nemá v potravě mléčné výrobky, přijímá denně v potravě kolem 0,5 g vápníku. Pro udržení rovnováhy mezi příjmem a výdejem vápníku a tím také stavu kostí je ale v dospělosti třeba dvojnásobku uvedeného množství. Další půlgram vápníku lze s výhodou doplnit mléčnými výrobky (denně půl litru nízkotučného mléka, 65 gramů tvrdého tvarohu nebo eidamského sýra nebo čtvrt litru bílého jogurtu). Zvažovat se má také biologická dostupnost vápníku, protože zatímco u dětí je účinnost absorpce vápníku kolem 75 %, v dospělosti je jen 30–50% a ve stáří ještě klesá. Absorpční schopnost střeva pro vápník klesá při deficitu sexagenů a vitaminu D a při hyperkortizolismu, v přítomnosti kyseliny fytové a šťavelové, nadměrného množství vlákniny, solí hořčíku, draslíku a sodíku. U osob se sníženou produkcí žaludeční šťávy je absorbovatelnost vápníku nalačno zhoršená, ale při podání vápníku s potravou bývá normální. Doporučený denní přívod vápníku, celkově 1 g denně, má být zajištěn u zdravých mužů a také při medikamentózní léčbě osteoporózy. Pokud se podá až 500 mg vápníku, absorbuje se rychle aktivním transportem, při podání většího množství vápníku se absorbuje pasivním transportem podle koncentračního gradientu, a proto pomaleji. Proto je vhodné vápník podávat při jídle a v dávkách nejvýše 500 mg. Podání vápníku večer před ulehnutím snižuje noční vrchol koncentrace parathormonu v krvi. Doporučený denní přívod 800 IU vitaminu D je vhodné zajistit celoročně při osteoporóze i při osteopenii. Aktivní metabolity vitaminu D (1alfa hydroxyvitamin D a kalcitriol) jsou vhodné pouze pro léčbu osteoporózy u pacientů se zhoršenými funkcemi ledvin. Vitamin D se uplatňuje také úpravou myopatie navozené hypovitaminózou D a následně snížením rizika pádů, a tím i zlomenin (zejména u starých osob v ústavní péči).
Pro nemocné s osteoporózou je vhodné doporučit cvičení, která zatěžují skelet a stimulují osteoblasty k novotvorbě kostní hmoty. Zejména je doporučováno pravidelné zatěžování skeletu rychlou chůzí 2–4 hodiny denně. Fyzicky aktivní muži mají významně nižší riziko zlomenin v oblasti kyčle než muži s nízkou fyzickou aktivitou .
Farmakoterapie
Léčba involuční osteoporózy
Cílem léčby osteoporózy je zlepšit, anebo alespoň udržet množství a kvalitu kostní hmoty a zabránit tak zlomeninám a zachovat nebo zlepšit kvalitu života. V ČR jsou léčebná opatření zajištěna jen u desetiny mužů a u čtvrtiny žen s osteoporózou podle DXA (graf 9). U mužů stojí léčení zlomenin v oblasti kyčle ročně 33,8 mil. € (~ 920 mil. Kč), léčení všech fraktur ~ 2,2 miliardy Kč. Na prevenci zlomenin u mužů se vydává 175 milionu Kč, tedy 13 % částky, kterou u mužů stojí léčení zlomenin .
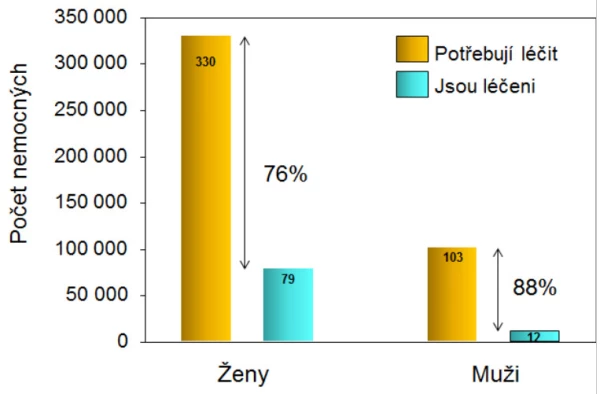
Graf 9. Zajištění léčby osteoporózy v České republice.
Účinnost a bezpečnost všech níže uvedených farmakologických opatření u mužů s osteoporózou byly ověřeny klinickými studiemi u pacientů, kteří splňovali vstupní kritéria dané studie. V klinické praxi léky většinou dostávají pacienti, kteří by do klinické studie nemohli být z různých důvodů zařazeni. Před zahájením léčby u jednotlivých pacientů je nutné vyloučit jiná metabolická a nádorová kostní onemocnění a během léčby očekávanou účinnost léku individuálně ověřovat. Zvláště to platí o léčení osteoporózy u starých mužů. Jedním z problémů je nedostatečná adherence k léčbě (schopnost a ochota pacienta dodržovat doporučený léčebný režim). Nedostatečná adherence vyjadřuje nedostatečnou compliance (léky jsou předepsány, ale pacient je neužívá doporučeným postupem) a perzistenci (pacient léčbu předčasně přeruší). Příčin nedostatečné adherence je řada, ať už jsou to osobní faktory (vzdělání, rodinný stav, motivace, vztah mezi lékařem a pacientem, informovanost pacienta o důsledcích podcenění rizika zlomenin, o povaze, přínosu a možných nežádoucích účincích léku, zdravotní obtíže, kouření, alkoholismus nebo zapomínání), faktory zdravotního systému (špatná dostupnost zdravotní péče, dlouhé objednací doby, obtížné vyzvedávání léku, cena léku), faktory nemoci (příznaky a tíže onemocnění), nebo charakteristika léčby (způsob, frekvence, složitost podávání léku, nutnost dlouhodobého užívání léku, nežádoucí účinky léčby, požadované změny denního režimu nebo stravování nebo složení léku) . Uvádí se, že po roce je compliance u mužů léčených alendronátem 32 %, že po dobu 3 let pokračuje v léčbě perorálními aminobisfosfonáty jen třetina mužů a že léčbu teriparatidem ukončuje do 18 měsíců čtvrtina mužů .
Jiným dosud málo řešeným problémem je účinnost léčby u starých a křehkých pacientů. Příkladem je výsledek studie účinnosti infuze kys. zoledronové, velmi účinného antiresorpčního léku osteoporózy, u 181 křehkých pacientů (průměrný věk 85 let), kteří vyžadovali trvalou dopomoc. Přestože způsobem podání léku byla zajištěna plná compliance a všichni pacienti současně dostávali vápník a vitamin D a přestože se u léčené skupiny v porovnání se skupinou na placebu po 2 letech významně zvýšila BMD bederní páteře, prox. femuru i distálního radia a nebyly rozdíly v nežádoucích účincích léčby, u léčených pacientů bylo riziko zlomenin zvýšené o 30 %, byť statisticky nevýznamně . Také při osteoanabolické léčbě se zdůrazňuje nezbytnost přiměřené fyzické aktivity pacientů. Před zahájením jakékoli léčby je také nezbytné upravit zásobení vápníkem a vitaminem D, protože to je podmínkou optimální účinnosti léčby .
Antiresorpční léčba
Cílem zpomalení remodelace kosti pomocí antiresorpčních léků je zabránit dalšímu zhoršování mikroarchitektury kosti, úbytku kostní hmoty a umožnit delší časové období pro sekundární mineralizaci kosti. Vytváření nové kostní hmoty však tyto léky nenavozují. V České republice jsou pro léčbu osteoporózy u mužů registrovány aminobisfosfonáty (risedronát a kyselina zoledronová), stronciumranelát a denosumab. Denosumab je u mužů registrován také k léčbě sekundární osteoporózy navozené androgendeprivační terapií karcinomu prostaty, pokud je zvýšené riziko zlomenin. Podle úhradové vyhlášky SÚKL jsou v současné době pro léčbu osteoporózy u mužů hrazeny aminobisfosfonáty (alendronát, ibandronát, risedronát a kyselina zoledronová) a stronciumranelát. Parenterální ibandronát je hrazen u mužů s denzitometricky potvrzenou osteoporózou a prodělanou zlomeninou.
Mechanismus útlumu osteoresorpce uvedenými léky je rozdílný. Aminobisfosfonáty inhibicí farnesyldifosfátsyntázy tlumí účinnost osteoklastů a navozují jejich apoptózu. Jednotlivé aminobisfosfonáty se liší nejenom stupněm vazby na kostní minerál, ale také stupněm biologického účinku a způsobem podávání. Denosumab ovlivněním signální dráhy ligandu pro RANK brání diferenciaci a tlumí funkci a přežívání osteoklastů.
Alendronát (10 mg denně) v prospektivní studii u 241 mužů o průměrném věku 63 let (31–87 let, u třetiny pacientů byla zjištěna nízká koncentrace testosteronu v krvi) a s BMD v páteři nebo v kyčli ≤ −2,0 SD zvyšoval po 2 letech BMD bederní páteře a krčku femuru a snížil průkazně riziko zlomenin obratlů (RR 0,1; 95% CI: 0–0,88; graf 10). Metaanalýza studií u mužů svědčila pro snížení rizika zlomenin obratlů, nikoli však neobratlových zlomenin .
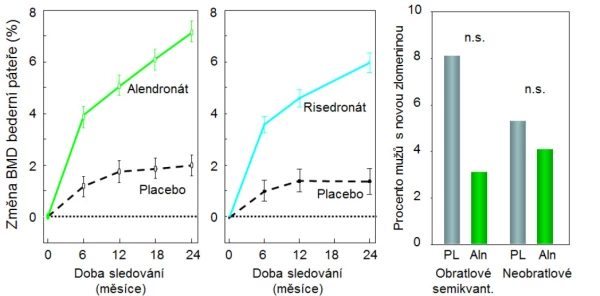
Graf 10. Alendronát (vlevo) a risedronát (uprostřed) navozují u mužů obdobné zvýšení BMD bederní páteře (BMD); vpravo: snížení rizika zlomenin obratlů nebylo po roce léčení alendronátem průkazné.
Risedronát (35 mg jednou za týden) byl testován v prospektivní studii u 284 mužů (randomizovaných v poměru 2 : l do skupiny léčené a kontrolní) o průměrném věku 62 let (36–84 let) a s BMD v páteři ≤ −2,5 SD a v krčku femuru ≤ −1 SD (nebo s BMD v páteři ≤ −1 SD a v krčku femuru ≤ −2 SD). Po 2 letech léčby se významně zvýšila BMD bederní páteře a krčku femuru (graf 10). Léčba byla účinná i u pacientů s nízkou sérovou koncentrací testosteronu. Studie dokumentovala trend ke snížení rizika zlomenin . Otevřená klinická studie potvrdila snížení rizika zlomenin obratlů (o 60 %) a neobratlových zlomenin (o 47 %) po 2 letech léčby mužů risedronátem . Další kontrolované studie prokázaly při 18měsíční léčbě risedronátem zvýšení BMD a snížení rizika zlomenin v oblasti kyčle u mužů po iktu a starších 65 let a zvýšení BMD a snížení rizika zlomenin obratlů u mužů s Alzheimerovou chorobou .
Ibandronát (150 mg jedenkrát za měsíc p. o.) byl při léčbě osteoporózy u mužů ověřen dvojitě zaslepenou studií kontrolovanou placebem. Placebo dostávalo 47 mužů, ibandronát 85 mužů. Po 12 měsících se BMD bederní páteře statisticky významně zvýšila o 3,5 % při léčbě proti 0,9 % ve skupině s placebem. Významné zvýšení bylo u léčených mužů zjištěno i v prox. femuru, krčku femuru a v distálním radiu. Biochemické markery kostní remodelace byly významně nižší jen u mužů s dobrou adherencí k léčbě . Parenterální podání ibandronátu u mužů upravuje remodelaci a mineralizaci kosti a snižuje její porotizaci .
Kyselina zoledronová byla klinicky testována v randomizované multicentrické dvojitě zaslepené studii u 302 mužů s osteoporózou. Infuzi s 5 mg kys. zoledronové dostávalo jednou ročně 154 mužů a 148 mužů bylo léčeno alendronátem (tableta, 70 mg jednou za týden) . U obou skupin se po dvou letech zvýšila BMD v bederní páteři o 6 % (graf 11). Další studie účinku kyseliny zoledronové na riziko zlomenin u mužů a žen (průměrný věk 75 let) po zlomenině v oblasti kyčle prokázala po roce léčby snížení rizika neobratlových zlomenin . Účinky léčby na BMD byly obdobné u žen i u mužů . Hojení zlomenin nebylo léčbou nepříznivě ovlivněno. V další placebem kontrolované studii u 1 199 mužů ve věku 50–85 let se při léčbě kys. zoledronovou snížilo po 2 letech relativní riziko zlomenin obratlů o 67 % (absolutně o 3,3 %) . Kys. zoledronová významně snižuje markery kostní remodelace a zvyšuje BMD také u mužů s idiopatickou osteoporózou, hypogonadismem a s glukokortikoidy indukovanou osteoporózou . Podmínkou podání kyseliny zoledronové je dostatečná hydratace pacienta. Reakce akutní fáze (horečka, artralgie, myalgie) do 3 dnů po infuzi uvádí 45 % pacientů; příznaky lze zmírnit opakovaným podáváním paracetamolu; většinou odeznívají do 3 dnů. Při opakovaných infuzích procento pacientů s tímto nežádoucím účinkem výrazně klesá. Útlum kostní remodelace po infuzi kyseliny zoledronové se mírně upravuje během dalšího ročního intervalu, kdy nejsou osteoblasty vystaveny opakované inhibici, jako je tomu při léčbě jinými aminobisfosfonáty.
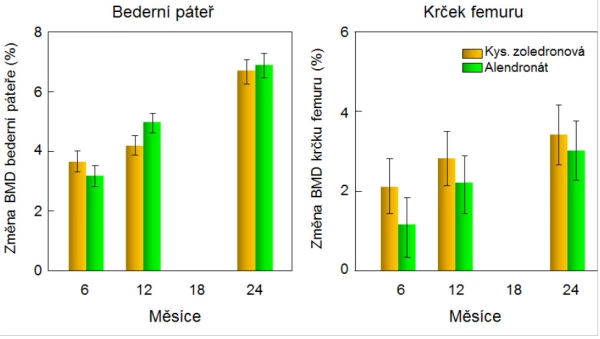
Graf 11. Změny BMD bederní páteře a krčku femuru u mužů s osteoporózou léčených kys. zoledronovou (n = 152) nebo alendronátem (n = 148), rozdíly mezi změnami BMD v jednotlivých časech nebyly statisticky významné.
Léčba perorálními aminobisfosfonáty není vhodná u pacientů neschopných zůstat ve vzpřímené poloze po dobu 30 minut, při krvácení do GIT v posledním roce, u pacientů s rekurentní nebo aktivní vředovou chorobou gastroduodenální, gastroezofageálním refluxem nebo tehdy, pokud je prokázána striktura, achalázie nebo porucha motility jícnu. Léčba aminobisfosfonáty není vhodná při kontraindikaci podávání vápníku nebo vitaminu D, při koncentraci vápníku v séru nižší než 2,1 mmol/l a přesahující 2,65 mmol/l, při deficienci vitaminu D (S-25(OH)D < 25 nmol/l), při leukopenii (< 2 500/µl), při zvýšení ALT nad dvojnásobek normy, snížení S-albuminu na < 30 g/l, při clearance kreatininu < 0,6 ml/s. Osteonekróza čelisti jako komplikace léčby aminobisfosfonáty se uvádí při léčbě nádorových onemocnění, ale při léčbě osteoporózy aminobisfosfonáty je mimořádně vzácná. Léčba by měla trvat po dobu 4–5 let, po kterou klinické studie doložily její bezpečnost pro kvalitu kosti. U některých pacientů může déletrvající nadměrný útlum kostní remodelace, zejména při léčbě alendronátem, navodit atypickou zlomeninu.
Denosumab je plně lidská monoklonální protilátka proti RANK ligandu, která byla na základě výsledků klinických studií registrována pro léčbu osteoporózy u mužů. Ve dvojitě zaslepené studii u 242 mužů (průměrný věk 65 let, studii ukončilo 219 mužů), kteří dostávali po 6 měsících denosumab (60 mg s. c.) nebo placebo, se BMD po roce významně zvýšila ve všech měřených místech skeletu a zvyšovala se i v dalším roce (graf 12). U mužů, kteří dostávali placebo po dobu 1 roku, se po převedení na denosumab BMD rovněž významně zvýšila. Studie neměla statistickou sílu pro hodnocení rizika zlomenin, ale změny BMD i sérových markerů remodelace kosti byly u mužů obdobné, jako tomu bylo ve studiích, které prokázaly snížení rizika zlomenin u mužů s androgendeprivační terapií pro karcinom prostaty a u žen s osteoporózou léčených denosumabem v registrační studii .
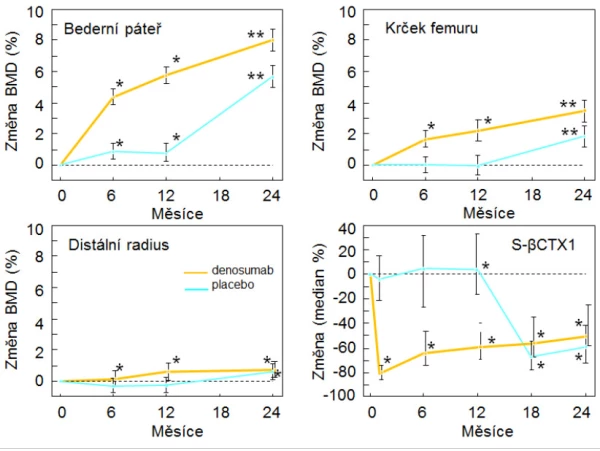
Graf 12. Změna BMD a markeru osteoresorpce u mužů léčených denosumabem pro osteoporózu, * p < 0,05, ** p < 0,001.
Hodnotit účinek denosumabu na snížení rizika zlomenin bylo možné ve dvojitě zaslepené kontrolované studii u 1 468 mužů s androgendeprivační terapií pro karcinom prostaty. V porovnání s placebovou skupinou se při podávání denosumabu (s. c. 60 mg po 6 měsících) významně zvýšila BMD v bederní páteři, v krčku femuru, v celkovém proximálním femuru a v radiu a po 3 letech byla incidence nových zlomenin obratlů u léčených mužů o 62 % nižší než v placebové skupině (1,5 % vs. 3,9 %; p < 0,006; graf 13).
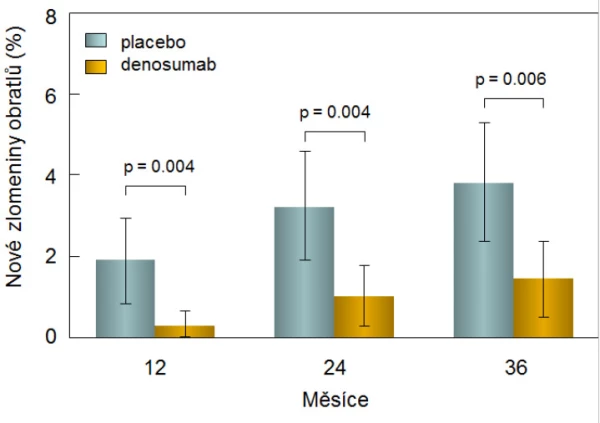
Graf 13. Incidence nových zlomenin obratlů u pacientů s osteoporózou navozenou androgendeprivační terapií nemetastazujícího karcinomu prostaty léčených placebem nebo denosumabem.
Stronciumranelát (2 g/den p. o.) v otevřené studii u mužů navodil po roce větší zvýšení BMD než alendronát . Ve studii kontrolované placebem u mužů v průměrném věku 73 let se po 2 letech zvýšila BMD bederní páteře i prox. femuru . Stroncium uložené v kostech však absorbuje rentgenové záření více než vápník a výpověď osteodenzitometrie nekontrolovaně nadhodnocuje. Osteoanabolický, resp. duální účinek stronciumranelátu nebyl prokázán ani při hodnocení biochemických markerů kostní remodelace ani v histomorfometrických studiích nepárových i párových biopsií u žen s postmenopauzální osteoporózou léčených doporučenými dávkami SrR. Nedoporučuje se podávat stronciumranelát pacientům se závažným poškozením funkce ledvin (clearance kreatininu < 0,5 ml/s) a s rizikem tromboembolie, s ischemickou chorobou srdeční a nekorigovanou hypertenzí. Závažnou komplikací zdravotního stavu může být syndrom DRESS .
Osteoanabolická léčba
Pro léčbu osteoporózy u mužů a glukokortikoidy indukované osteoporózy u mužů je v České republice registrován rekombinantní fragment PTH 1-34 (teriparatid). Lék má plně zachovanou biologickou účinnost nativního PTH na kostní metabolismus a kalciofosfátový metabolismus. Kvalita novotvořené kostní hmoty je zcela normální. Lék se aplikuje s. c. jednou denně pomocí injekčního pera. Nutnými předpoklady pro plnou účinnost léčby jsou zajištění dostatečného denního přívodu vápníku (1–1,5 g denně) a vitaminu D (800 IU denně) a zajištění přiměřené fyzické aktivity. Doporučená doba podávání léku je 24 měsíců. V České republice je léčba u mužů hrazena, jen pokud selhala předchozí nejméně 2 roky trvající antiresorpční terapie a pokud má pacient zlomeniny nejméně 2 obratlů a současně BMD v bederní páteři horší než −2,9 T-skóre. Výjimkou je léčba glukokortikoidy indukované osteoporózy (viz níže).
V prospektivní studii u 437 mužů s idiopatickou osteoporózou navodil teriparatid (20 μg/den, s. c. jednou za den) po 11 měsících sledování zvýšení BMD bederní páteře o 5,9 % a v krčku femuru o 1,5 % (p < 0,001) . Stupeň zvýšení BMD při léčbě teriparatidem byl u mužů obdobný jako při léčbě teriparatidem u žen (graf 14). Sledování pacientů z prospektivní studie po dalších 30 měsíců prokázalo pokles BMD po ukončení léčby teriparatidem . Pokud pacienti dostávali po ukončení anabolické léčby antiresorpční léky, BMD se udržela a riziko středních a těžkých deformit obratlů se snížilo o 83 % (p < 0,01). Současné podávání teriparatidu a risedronátu u mužů zvyšuje BMD více než jednotlivé léky, není však výhodné z hlediska snížení rizika zlomenin .
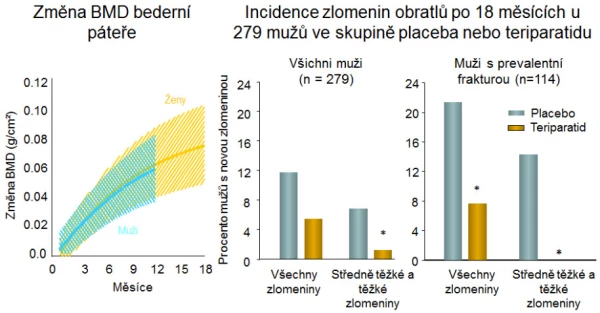
Graf 14. Účinnost osteoanabolické léčby teriparatidem u mužů, * p < 0,05.
Souhrn
Porovnání účinnosti jednotlivých farmakoterapeutických opatření při léčbě osteoporózy u mužů má řadu omezení. Přesto lze pro klinickou praxi použít výsledků metaanalýzy, která hodnotila zvýšení BMD v bederní páteři a snížení rizika zlomenin u mužů při různých režimech léčby (graf 15). BMD páteře se zvyšovala nejvíce při léčbě kys. zoledronovou anebo kombinací antiresorpční a osteoanabolické léčby. Riziko zlomenin u mužů nejlépe snižuje osteoanabolická léčba teriparatidem anebo kys. zoledronovou. Tyto závěry opět potvrzují význam zlepšení kvality kostní hmoty pro snížení rizika zlomenin.

Graf 15. Účinnost antiresorpční a osteoanabolické léčby osteoporózy u mužů; podle .
ALE = alendronát; PLA = placebo; ALF = alfakalcidol; RIS = risedronát; IBA = ibandronát; ZOL = kys. zoledronová; STR = stronciumranelát; TER = teriparatid; PTH = parathormon.
Léčba sekundární osteoporózy
Léčba osteoporózy má být kauzální. Protože polovina až dvě třetiny onemocnění osteoporózou u mužů má prokazatelné sekundární příčiny úbytku kostní hmoty, je předpokladem zahájení jakékoli léčby klinické a laboratorní vyšetření a zjištění příčiny osteoporózy. Pokud je u mužů s nízkou kostní hmotou vyloučeno jiné metabolické nebo nádorové onemocnění skeletu, ale je prokázána některá z příčin sekundární osteoporózy (tab. 1), je nutné včas diagnostikovat a léčit základní příčinu úbytku kostní hmoty. Na tomto místě lze zmínit jen studie věnované léčbě osteoporózy navozené deficiencí testosteronu a léčbě osteoporózy indukované glukokortikoidy.
Léčení osteoporózy při deficienci testosteronu
Testosteron. Až 30 % onemocnění osteoporózou u mužů je zapříčiněno deficiencí testosteronu . Osteoporóza může být u mužů s prokazatelně dlouhodobým deficitem sexagenů léčena substitucí androgeny. Platí to v případech, kdy se prokáže hypogonadismus (nízké koncentrace celkového a volného testosteronu a zvýšené koncentrace luteinizačního hormonu v séru). Léčbu má zásadně indikovat a kontrolovat endokrinolog, který rozhoduje o způsobu a trvání léčby. Je třeba zvažovat přínos a rizika léčby. Androgeny mohou zhoršit hyperplazii prostaty, urychlit růst karcinomu prostaty, nežádoucím způsobem ovlivnit profil sérových lipidů a navodit retenci tekutin. Před zahájením léčby je vhodné ověřit normální nález při vyšetření prostaty zkušeným urologem, koncentraci prostatického sérového antigenu a koncentrace sérových lipidů. Léčbu lze zahájit ověřením, že testosteron ve zvoleném dávkování (např. testosteron izobutyrát v dávce 50 mg intramuskulárně každé 2 týdny) nemá nežádoucí klinické ani biochemické účinky. Pokud se nežádoucí účinky neprokážou, zvyšuje se postupně dávka testosteronu každý měsíc, až se ustálí na 50–200 mg intramuskulárně každé 2 týdny při pokračujícím hodnocení nežádoucích účinků. U starších nemocných se osvědčuje mesterolon v dávce 1–2 tablety denně.
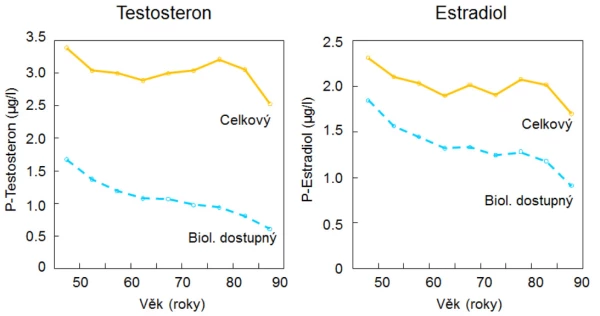
Antiresorpční i osteoanabolická léčba je u mužů účinná bez ohledu na sérové koncentrace testosteronu, a není tedy důvod k současné hormonální substituci při těchto způsobech léčby . Účinky testosteronu a selektivních modulátorů estrogenních receptorů nebyly až na výjimky ověřeny kontrolovanými randomizovanými studiemi . Zatím nejsou k dispozici data pro doporučení dlouhodobé léčby osteoporózy a prevenci zlomenin u mužů testosteronem. Stanovení koncentrace sexagenů v krvi není doporučeno pro populační screening mužů ohrožených zlomeninami, ale je spolu s SHBG vhodnou součástí laboratorního vyšetření u mužů s prokázanou osteoporózou. Substituční léčba testosteronem zpomaluje rychlost úbytku kostní hmoty a zvyšuje BMD bederní páteře (graf 16).
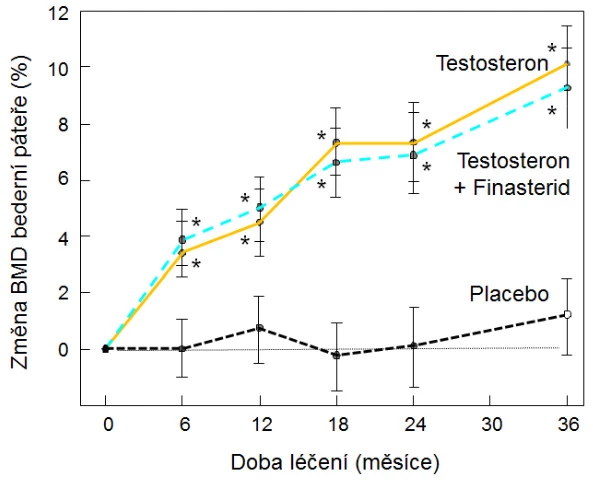
Graf 16. Vliv substituce testosteronem (200 mg i. m. po 14 dnech) bez bloku konverze na dihydrotestosteron (finasterid, 5 mg/den) nebo s ním u mužů ≥ 65 let s koncentrací sérového testosteronu < 3,5 µg, p < 0,05, proti placebu a vstupní hodnotě.
Selektivní modulátory estrogenních receptorů (SERM) nejsou doporučovány jako terapie involuční OP u mužů zejména proto, že i starší muži mají sérovou koncentraci estradiolu významně vyšší než ženy po menopauze (graf 2). Účinnost SERM však byla opakovaně ověřena při léčbě osteoporózy u mužů s velmi nízkou sérovou koncentrací estrogenů . Raloxifen bránil úbytku kostní hmoty také u mužů na androgendeprivační terapii a toremifen u nich snižoval riziko zlomenin na polovinu .
Selektivní inhibitory androgenních receptorů jsou v současné době ve fázi vývoje a ověřování.
Léčba osteoporózy indukované glukokortikoidy (GIO)
Antiresorpční léčba osteoporózy indukované glukokortikoidy byla u mužů testována při podávání tří různých aminobisfosfonátů. Ve studiích s alendronátem a risedronátem se v porovnání s kontrolní skupinou statisticky významně zvyšovala BMD v bederní páteři i v proximálním femuru . Ve skupině léčené alendronátem i risedronátem mělo zlomeniny obratlů méně pacientů než v kontrolní skupině . Účinnost kyseliny zoledronové (5 mg v infuzi jednou ročně) v porovnání s léčbou risedronátem (tableta, 5 mg denně) byla v uvedené indikaci ověřena v randomizované dvojitě zaslepené studii u 833 mužů a žen léčených ≥ 7,5 mg prednizonu buď ≤ 3 měsíce (preventivní studie, 88 mužů, 200 žen), nebo ≥ 3 měsíce (léčebná studie, 177 mužů a 368 žen). V posléze uvedené studii se po 12 měsících zvýšila BMD bederní páteře při léčbě kyselinou zoledronovou (4,1 %) více než při podávání risedronátu (2,7 %). Pokud byla léčba bisfosfonáty zahájena v prvních 3 měsících terapie glukokortikoidy, kyselina zoledronová navodila po roce zvýšení BMD o 2,6 % a risedronát o 0,64 %. Rozdíl změn BMD byl statisticky významný u mužů i u žen v preventivní i léčebné studii . Při obou způsobech terapie klesaly koncentrace biochemických markerů degradace i syntézy kolagenu typu I již v prvních 10 dnech. Během dalšího sledování zůstávaly koncentrace obou markerů při léčbě risedronátem v rozmezí referenčních hodnot, které byly publikovány u zdravých žen před menopauzou. Při léčbě kyselinou zoledronovou se koncentrace markerů vrátily do tohoto rozmezí po 6–12 měsících. Také při léčbě GIO alendronátem klesaly uvedené markery obdobně jako po podání kyseliny zoledronové, ale výrazný útlum kostní remodelace signalizovaný markery přetrvával po celou dobu léčby . Pro léčení GIO je v České republice hrazeno podání kyseliny zoledronové jednou za rok (5 mg v nejméně 15minutové infuzi) u nemocných, kteří mají hodnotu BMD nižší než −1,5 T-skóre. Ostatní aminobisfosfonáty lze podávat, pokud je osteoporóza prokázána osteodenzitometricky (BMD ≤ −2,5 SD).
Osteoanabolická léčba osteoporózy indukované glukokortikoidy je v České republice zajišťována pouze teriparatidem (rekombinantní fragment 1-34 lidského PTH). Je to kauzální léčba onemocnění, které je způsobeno nadměrným útlumem kostní remodelace glukokortikoidy. Léčbu lze považovat za první volbu pro muže a ženy léčené glukokortikoidy v denní dávce odpovídající 5 mg nebo více prednizonu po dobu nejméně 6 měsíců, pokud mají T-skóre v oblasti bederní páteře ≤ −2,5 SD.
Z přímého porovnání změn markerů při podávání alendronátu nebo teriparatidu je zřejmý významný rozdíl mezi oběma typy léků (graf 17) nejenom co do změny BMD, ale také z hlediska mechanismu účinků. Zatímco alendronát remodelaci kosti tlumí a marker syntézy kostního kolagenu klesá o více než 50 %, při léčbě teriparatidem se již během jednoho měsíce významně zvyšuje novotvorba kosti a vzhledem k mnohem mírnějšímu vzestupu osteoresorpce se otvírá anabolické okno. Účinky antiresorpční a osteoanabolické léčby na riziko zlomenin byly porovnány v randomizované studii s alendronátem a teriparatidem . Po 18 měsících a dále pak po 36 měsících bylo při léčbě teriparatidem v porovnání se skupinou pacientů léčených alendronátem absolutní riziko zlomenin obratlů několikanásobně nižší (graf 18).
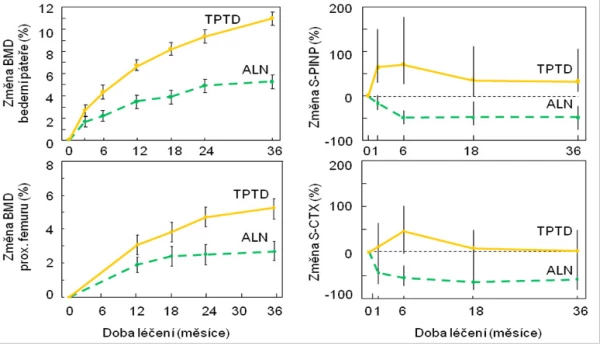
Graf 17. Změny denzity kostního minerálu (BMD) v bederní páteři a v proximálním femuru a změny sérové koncentrace markerů degradace a syntézy kolagenu typu I (S-CTX a S-PINP) během 3 let léčení glukokortikoidy indukované osteoporózy alendronátem nebo teriparatidem.
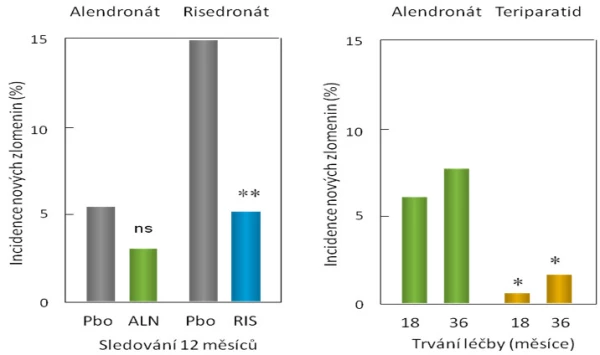
Graf 18. Účinnost léčby aminobisfosfonáty a teriparatidem na snížení rizika morfometrických zlomenin obratlů u pacientů s osteoporózou indukovanou glukokortikoidy.
Vlevo: Pacienti s glukokortikoidy indukovanou osteoporózou, kteří během uvedené doby užívání aminobisfosfonátů nebo placeba utrpěli novou zlomeninu obratle; podle a .
Vpravo: Pacienti s glukokortikoidy indukovanou osteoporózou, kteří po 18 a 36 měsících užívání alendronátu nebo teriparatidu utrpěli novou zlomeninu obratle. Tato studie nebyla kontrolována placebem, a není proto známo absolutní riziko zlomenin u neléčených osob. Pacienti byli náhodně rozděleni do jedné ze skupin s aktivní léčbou, * statistická významnost rozdílu mezi léčenými skupinami, p = 0,004; ** statistická významnost rozdílu skupiny s risedronátem a skupiny dostávající placebo, p < 0,05.
Závěr
Přestože jedna třetina všech zlomenin proximálního femuru postihuje muže a přestože v České republice jsou registrovány léky osteoporózy u mužů, je osteoporóza u mužů nedostatečně diagnostikovaným a nedostatečně léčeným onemocněním, v jehož epidemiologii a patofyziologii zůstává zatím řada nerozřešených otázek. Diagnostikovat a léčit osteoporózu je nezbytné zejména u mužů s prodělanou nízkotraumatickou zlomeninou a u mužů léčených glukokortikoidy. Osteodenzitometricky se osteoporóza zjistí jen u 21 % mužů s neobratlovými zlomeninami a jen u 39 % mužů, kteří utrpí zlomeninu v oblasti kyčle. Měření BDM je proto jen vhodným doplňkem hodnocení rizika zlomenin podle klinických faktorů. V prevenci zlomenin mužů má zásadní význam nejenom farmakoterapie osteoporózy, ale významná jsou také opatření vedoucí ke zlepšení svalové síly a koordinace a opatření ke snížení rizika pádů.
- Melton L. J., 3rd. Epidemiology of fractures. In: Riggs B. L., Melton L. J., 3rd, eds. Osteoporosis: etiology, diagnosis and management. New York: Raven Press; 1995 : 133-54.
- Schuit S. C., van der Klift M., Weel A. E., et al. Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study. Bone 2004; 34 (1): 195–202.
- Pasco J. A., Lane S. E., Brennan S. L., et al. Fracture risk among older men: osteopenia and osteoporosis defined using cut-points derived from female versus male reference data. Osteoporos Int 2014; 25 (3): 857–62.
- Seeman E. Clinical review 137: Sexual dimorphism in skeletal size, density, and strength. J Clin Endocrinol Metab 2001; 86 (10): 4576–84.
- Riggs B. L., Melton L. J., 3rd, Robb R. A., et al. Population-based study of age and sex differences in bone volumetric density, size, geometry, and structure at different skeletal sites. J Bone Miner Res 2004; 19 (12): 1945–54.
- Kirmani S., Christen D., van Lenthe G. H., et al. Bone structure at the distal radius during adolescent growth. J Bone Miner Res 2009; 24 (6): 1033–42.
- Khosla S. Update in male osteoporosis. J Clin Endocrinol Metab 2010; 95 (1): 3–10.
- Seeman E. Pathogenesis of bone fragility in women and men. Lancet 2002; 359 (9320): 1841–50.
- Lu P. W., Cowell C. T., Lloyd-Jones S. A., Briody J. N., Howman-Giles R. Volumetric bone mineral density in normal subjects, aged 5-27 years. J Clin Endocrinol Metab 1996; 81 (4): 1586–90.
- Garn S. M. The course of bone gain and the phases of bone loss. Orthop Clin North Am 1972; 3 (3): 503–20.
- Riggs B. L., Melton L. J., Robb R. A., et al. A population-based assessment of rates of bone loss at multiple skeletal sites: evidence for substantial trabecular bone loss in young adult women and men. J Bone Miner Res 2008; 23 (2): 205–14.
- Mellstrom D., Vandenput L., Mallmin H., et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures. J Bone Miner Res 2008; 23 (10): 1552–60.
- Khosla S., Melton L. J., 3rd, Atkinson E. J., O’Fallon W. M. Relationship of serum sex steroid levels to longitudinal changes in bone density in young versus elderly men. J Clin Endocrinol Metab 2001; 86 (8): 3555–61.
- Seeman E. Invited Review: Pathogenesis of osteoporosis. Journal of applied physiology 2003; 95 (5): 2142–51.
- Ferrini R. L., Barrett-Connor E. Sex hormones and age: a cross-sectional study of testosterone and estradiol and their bioavailable fractions in community-dwelling men. Am J Epidemiol 1998; 147 (8): 750–4.
- Svedbom A., Hernlund E., Ivergård M., et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8 (137): 35–42.
- Štěpán J. J., Vaculík J., Pavelka K., Žofka J., Johansson H., Kanis J. A. Hip fracture incidence from 1981 to 2009 in the Czech Republic as a basis of the country-specific FRAX model. Calcif Tissue Int 2012; 90 (5): 365–72.
- Schaffler M. B., Choi K., Milgrom C. Aging and matrix microdamage accumulation in human compact bone. Bone 1995; 17 (6): 521–25.
- Johnell O, Kanis J. Epidemiology of osteoporotic fractures. Osteoporos In
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



