-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPsoriáza: patofyziologické mechanizmy, léčba
Datum publikace: 22. 1. 2016
Úvod
Psoriáza je chronická zánětlivá dermatóza postihující kolem 2 – 4 % středoevropské populace. Nejedná se o život ohrožující onemocnění, ale má obrovský vliv na fyzickou, sociální a hlavně psychickou stránku života. Na druhou stranu už dnes víme, že lupénka není jen povrchová kožní choroba, ale je spojena s řadou komorbidit, jakými jsou psoriatická artritida (přibližně 25 %), Crohnova choroba, ulcerózní kolitida, Bechtěrevova choroba a zejména nemoci tzv. metabolického syndromu, jako je např. diabetes mellitus 2. typu, arteriální hypertenze nebo dyslipidémie, což může snížit délku života psoriatika o 3,5 až 10 let ve srovnání se zdravou populací.
I když v poznatcích patogeneze psoriázy došlo v posledních deseti letech k obrovskému pokroku, stále není zdaleka vše úplně jasné. Uvažuje se o autoimunitní etiologii choroby, v níž zásadní roli hrají T lymfocyty, což podporují i pozitivní výsledky immunosupresivní léčby.
Pacienti bývají často nespokojení s terapií, a proto je potřeba individuální přistup a snaha využít všechny terapeutické možnosti, které mohou být místní nebo celkové. Do druhé skupiny patří léčba UV zářením, methotrexatem, cyklosporinem a acitretinem, které jsou také nazývány klasická systémová terapie. Druhou možností jsou biologika, jinými slovy moderní systémová léčba. Fumaráty, které se používají v Německu, v ČR nejsou schválené pro léčbu lupénky.
Patogeneze
Psoriáza je komplexní kutánní dysregulace, která integruje většinu buněčných typů a mediátorových systémů kůže. U některých těchto systémů dosud není jasná úloha v patogenezi onemocnění; v zásadě se jedná o Th1 a Th17 - lymfocytární zánětlivou reakci, která je doprovázena epidermální hyperproliferací a poruchou diferenciace. Mezi nejnápadnější histologické změny patří: hyperplazie epidermis, chybění stratum granulosum, ztluštělé parakeratotické stratum corneum, lymfoleukocytární infiltrát v papilární časti dermis, Munroovy mikroabscesy a angiogeneze.
Proliferace je enormně vystupňována – nacházíme několikanásobně více mitóz než v normální epidermis i na suprabazální úrovni. Vyzrávání keratinocytů od bazální vrstvy až po stratum corneum je z normálních 28 dní zkráceno na pouhých 5, což vysvětluje výše zmíněnou poruchu diferenciace. Keratinocyty exprimují specifické hyperproliferanční markery jako Keratin K6/16 a HSP (heat shock protein). Taková konstelace se podobá časné fázi epidermálního hojení.
Zánětlivý infiltrát vykonává chronickou persistentní zřejmě antigen-specifickou odpověď efektorových buněk. Převládají paměťové Th1 a Th17 - buňky, které jsou vybaveny tzv. „skin-homing“ receptorem CLA a chemokinovým receptorem CCR4. Ty produkují jako odpověď na stálou prezentaci neznámých antigenů široké spektrum cytokinů a chemokinů.
Genetická predispozice. Studie prevalence psoriázy, dvojčecí studie a genetické studie prokázaly existenci genetické predispozice a identifikovaly alely asociované s rozvojem psoriázy. Rovněž byly identifikovány geny hrající centrální roli v imunitní odpovědi (HLAC,IL12B,IL23A,IL23R,IL2/IL21 aj.), tyto geny se mohou překrývat s geny jiných zánětlivých onemocnění, jako je Crohnova choroba.
Environmentální faktory. Virová či bakteriální infekce (přesněji beta-hemolytický streptococus) často předchází rozvoj psoriázy. Stimulace autoantigeny, mechanické poranění a komplexy antimikrobiálního peptidu LL37 s vlastní DNA a RNA jsou zvažovány jako možné spouštěče, nicméně je nutné jejich další studium. Jako další faktory jsou obecně deklarovány léky (např. beta-blokátory, lithium, antimalarika, inhibitory ACE, interferony, někdy i blokátory kalciového kanálu a mnoho dalších) a životní styl (stres,kouření).
Onemocnění začíná aktivací T-lymfocytů neznámým antigenem nebo genovým produktem. T-buněčná aktivace je závislá na vazbě s APC (antigen presenting cells). V nejbližší lymfatické uzlině T-buňky následně exprimují T-buněčný receptor (TCR), který rozpoznává peptid prezentovaný APC na MHC komplexu. Antigen stiumulovaná odpověď vede ke konverzi těchto naivních T-buněk na paměťové a specifické T-lymfocyty (Th17,Tc17,Th1,Tc1), které jednak cirkulují organismem a jednak se vrací zpět do kožní tkáně. To, zda se T-buňka diferencuje na určitý typ spefické efektorové buňky, rozhoduje interleukin exprimovaný antigen prezentující buňkou: buď IL-12, nebo IL-1/IL-23. Po aktivaci T-lymfocytů dojde k sekreci mnoha cytokinů jako GMCSF (granulocyt macrophage colony stimulating factor), IFN-gamma, TNF-alfa, EGF, IL-1,IL-6,IL-8, IL-12,IL-17,IL-23 a dalších. Odpovědí na kaskádu zmíněných cytokinů je proliferace keratinocytů, migrace neutrofilů, potenciace Th-1 buněčné odpovědi, angiogeneze, upregulace adhezivních molekul a epidermální dysplasie.
Začarovaný kruh se uzavírá neustálou interakcí dendritických buněk (APC), keratinocytů a lymfocytů, jejímž výsledkem je stálá prozánětlivá reakce.
PASI, DLQI
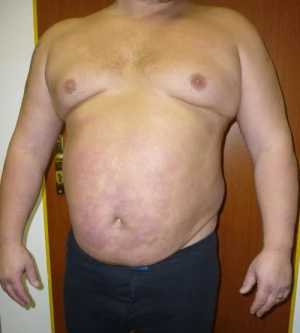
Typickými kožními projevy psoriázy jsou erytémová ložiska, vzniklá z primárních papulózních eflorescencí, která mohou být infiltrovaná a zašupená (obr.1). Pro nutnost objektivizovat závažnost lupénky byly definovány různé indexy. V roce 1978 byl poprvé použit PASI index (Psoriasis Area and Severity Index) a to v klinické studii s retinoidy. PASI indexem objektivně stanovujeme procento postižení těla psoriázou, při kterém se hodnotí zarudnutí, infiltrace a deskvamace ložisek. Výsledkem může byt číslo od 0 (bez psoriázy) do 72 (pacient v erytrodermii, silně zašupený). Pacient, který má PASI nad 10, se považuje za pacienta se středně těžkou psoriázou a je kandidátem na fototerapii či jinou systémovou léčbu. V posledních klinických studiích, zejména zkoumajících biologickou léčbu, bylo nejčastěji použito PASI 75, což znamená procento pacientů, kteří se zlepšili nejméně o 75 % oproti původnímu PASI (obr.2). Dále se používá Physicians Global Assessment (PGA), kdy lékař objektivně posuzuje, zda se jedná o mírnou nebo velmi těžkou formu psoriázy a nakonec se stanovuje i Body Surface Area (BSA), tj. procento tělesného povrchu postiženého psoriázou.

Lupénka má bohužel silný dopad i na psychiku pacienta. V literatuře je uvedeno, že až 10 % psoriatiků trpí depresemi. Proto používáme kromě PASI indexu, který vyplňuje lékař, i indexy (dotazníky), které vyplňuje sám pacient. Ukazují nám, jaký dopad má lupénka na kvalitu jeho života (SF-36, Skin index a další). Nejčastěji se používá DLQI (Dermatology Life Quality Index), dotazník obsahující 10 otázek o pocitech, práci, volném čase pacienta a léčbě psoriázy. Celkové skóre může být od 0 do 30, nižší hodnoty ukazují, že onemocnění má malý dopad na kvalitu života a opačně vyšší hodnoty výrazně omezují pacienta v každodenních aktivitách. Proto terapie, která snižuje PASI o 75 % oproti původní hodnotě, by měla i výrazně snížit DLQI skóre.
Lokální léčba
Lokální terapie psoriázy patří k první volbě vzhledem k minimálnímu vzniku nežádoucích účinků. Ke starším látkám, které dnes využíváme, patří kyselina salicylová, kortikosteroidy, dehet, dithranol, a z novějších deriváty vitaminu D (calcipotriol, calcitriol, tacalcitol, maxacalcitol) samostatně nebo v kombinaci s kortikoidem, a retinoidy (tazaroten). Nevýhodou derivátů vitaminu D je riziko hyperkalcémie, proto musí být definován maximální rozsah, který je doporučen dermatologem. Momentálně probíhají klinické studie s novým derivátem, který by neměl zvyšovat hladinu kalcia v krvi. Relativně nově je na českém trhu šampón nebo pěna s obsahem clobetasol propionátu, který se aplikuje jedenkrát denně.
Fototerapie
V léčbě psoriázy se začalo využívat tzv. horské slunce téměř před sto lety a již více než padesát let je využíváno selektivnější a bezpečnější UVB i UVA záření. Často se setkáváme s názvem fotochemoterapie, což znamená aplikaci psoralenu před ozářením UVA spektrem. Fototerapie snižuje mobilitu Langerhansových buněk, inhibuje aktivaci T – lymfocytů a indukuje apoptózu aktivovaných T – buněk. Dále blokuje epidermální hyperproliferaci při interakci s DNA keratinocytů. Před zahájením terapie je nutno vyloučit maligní kožní nádory, fotoalergickou nebo fototoxickou medikaci a fotodermatózy. Celotělové ozařování je nevhodné pro osoby s klaustrofobií a s těžkým kardiovaskulárním onemocněním. Pokud se rozhodneme pro systémovou fotochemoterapii (podáním psoralenu p.o.), je předtím nutno zkontrolovat hladinu jaterních enzymů, provést oční vyšetření k vyloučení katarakty a poučit pacientky o kontraindikaci otěhotnění a kojení. Bezpečnost metody také zvyšuje ochrana očí brýlemi či zakrývání některých částí těla, jako je genitál, obličej anebo pigmentové névy. První kontrola lékařem při fototerapii je vhodná většinou do dvou týdnů od jejího zahájení či kdykoliv v jejím průběhu při vzniku komplikací. Při nedostatečné odpovědi nebo pro rychlejší nástup účinku lze léčbu kombinovat také s acitretinem či výjimečně s methotrexatem. Promazávání emoliencii je doporučováno každému pacientovi, v zimních měsících je vhodné pacienta před terapií nechat zaklimatizovat při pokojově teplotě. Více než 75% pacientů dosáhne PASI 75 po 4-6 týdnech terapie. Po dosažení 200-250 sezení se však výrazně zvyšuje riziko vzniku kožních nádorů.
UVB
Vlnová délka UVB záření je 280-320nm. V léčbě psoriázy je nejvíce využívána úzkospektrální fototerapie o délce 311nm. Před první aplikací fototerapie je nutno stanovit fototyp pacienta a minimální erytémovou dávku (MED). Ta se stanovuje pomocí fototestů, které provádíme na zádech a odečítáme po 8 a případně po 24 hodinách. Vstupní dávka by pak měla být 70% MED. Dávku poté zvyšujeme až o 30% při dobré toleranci, při vzniku minimálního erytému o 20%. Pokud erytém přetrvává, dávka se nezvyšuje. Někdy může dojít až k bolestivému erytému, kdy je nutno léčbu přerušit do vyhojení a poté začít s dávkou o 50% nižší, než byla předešlá, (s 50% snížením oproti poslední dávce) a zvyšovat opatrně jen o 10%. Léčba většinou trvá 4-6 týdnů s frekvencí 3-5 ozáření za týden. Udržovací dávka se většinou nedoporučuje. UVB záření je možné kombinovat s dehtem (Goeckermanova metoda), cignolinem (Ingramova metoda) nebo s deriváty vitamínu D3.
Monochromatická excimerová fototerapie
Monochromatická excimerová fototerapie využívá vlnovou délku UVB 308 nm a v poslední době se v literatuře uvádí jako efektivní při léčbě psoriasis vulgaris. Může být použita jako excimerový laser, který se aplikuje selektivně přímo jen na psoriatická ložiska a tak neozařuje okolní zdravou kůži. Pokud se ale jedná o větší plochu, lze použít excimerovou lampu. V S3 Evropských guidelinech pro léčbu psoriázy se doporučuje začít dvakrát týdně v dávkách 2 x až 4 x vyšších než je minimální erytémová dávka (MED) a dle vzniku erytému eventuálně dávku zvýšit nebo snížit.
Fotochemoterapie PUVA
PUVA terapie znamená kombinaci fotosenzibilizujícího psoralenu s UVA zářením. V ČR byla donedávna registrována látka 8-methoxypsoralen pod firemním názvem Oxsoralen® cps. Psoralen může být podán buď systémově (per os) v dávce 0,6 mg/kg 1-2 hodiny před ozářením nebo může být rozpuštěn ve vodě (koupelová PUVA 15-20 minut při teplotě 32-37 st. C) s dávkou 0,5-1,0 mg/l či v krému (krémová PUVA s aplikací 1-2 hodiny před svícením) v dávce 0.0006-0.005 %. Fotosenzitivita po užití psoralenu přetrvává 6-8 hodin, během kterých by pacient neměl být vystaven slunečnímu záření a měl by si pečlivě chránit oči brýlemi s UV filtrem. Před první aplikací PUVA terapie je nutno stanovit kožní fototyp a minimální fototoxickou dávkou (MPD) pomocí fototestů, které odečítáme za 72-96 hodin při p.o. aplikaci psoralenu a po 96-120 hodinách při koupelové PUVĚ. Počáteční dávka by pak měla být 75% MPD pro systémovou PUVU a 30% MPD pro koupelovou PUVU. Další zvýšení při absenci erytému je o 30% dvakrát týdně, ne však dva dny po sobě, a to právě kvůli opožděnému nástupu fototoxické reakce. V opačném případě dávka zůstává stejná, a pokud dochází k bolestivému začervenání kůže, léčba je přerušena do vymizení projevů. Poté začínáme s 50 % snížením oproti poslední dávce a zvyšujeme opatrně jen o 10%. Po skončení intenzivní terapie (4-6 týdnů) je možno přejít na dvouměsíční udržovací terapii s poslední dosaženou dávkou v prvním měsíci dvakrát týdně a poté jedenkrát týdně. Po definitivním skončení jsou zkontrolovány jaterní enzymy a pacient je odeslán na oční vyšetření. Absolutně nutný je pečlivý zápis jednotlivých dávek k vypočtení kumulativní dávky, která by neměla za celý život přesáhnout 1000 J/cm2.
Cyklosporin
Cyklosporin A (CyA) je polypeptid, který má 11 aminokyselin a je produkován houbou Tolypocladium inflatum GAMS. Byl poprvé popsán v r. 1970. Patří mezi imunosupresivní léky, a mimo jiné je používán také k léčbě psoriázy, tuto indikaci má od r. 1993. Blokuje T lymfocyty, zejména T helpery a inhibuje produkci IL-2, IL-3, IL-4, IL-2R, IL-17, INF-γ, TNF-a, aktivaci NK buněk, monocytů a ovlivňuje funkci dendritických buněk. Po podání per os se vstřebává především v duodenu a jejunu, je eliminován žlučovými cestami a jeho biotransformace probíhá hlavně v játrech prostřednictvím cytochromu P-450, zejména isoenzymy CYP3A4,CPY3A5, ale i dalšími. Indikací je středně těžká až těžká forma psoriázy. Před nasazením je nutno provést kompletní klinické a biochemické vyšetření (kreatinin, kyselina močová, jaterní enzymy, bilirubin, ALP, natrium, kalium, magnesium, lipidy, vyšetření moči), krevní obraz a těhotenský test. Absolutní kontraindikací je renální insuficience, nekontrolovaná hypertenze, aktivní infekce a malignita (s výjimkou bazaliomu). Pokud rozhodneme o nasazení cyklosporinu, doporučuje se podávat v dávce 2,5 – 3 mg/kg, max. 5 mg/kg. Terapie může být intermitentní s průměrnou dobou podávání 12-16 týdnů s postupným snižováním dávky o 0,5 mg/kg každých 14 dnů do ukončení léčby anebo kontinuální, kdy po dosažení efektu zkusíme dávku snížit na tzv. udržovací, která se pohybuje mezi 0,5-3 mg/kg s maximálním podáváním 2 roky. Klinické zlepšení lze očekávat již po 4 týdnech. Limitující mohou být četné lékové interakce, které mohou zvýšit koncentraci CyA, ale zároveň také jeho toxicitu, jako jsou např. makrolidová antibiotika, antimykotika, antiarytmika, antagonisté kalcia nebo antilipidemika a další. Současně je zakázána i konzumace grapefruitového džusu. K nejčastějším nežádoucím účinkům patří renální selhání, hypertenze, jaterní selhání, hyperlipidemie, nauzea, anorexie, zvracení, průjem, hypertrichóza, hyperplasie dásně a zvýšené riziko malignit, např. vzniku kožních nádorů, a to zejména u pacientů, kteří dříve absolvovali fotochemoterapii. K zabránění výše uvedených nepříjemností je nutná úzká spolupráce s pacientem a pravidelné kontroly, a to jak klinické s měřením krevního tlaku, tak i laboratorní. V prvním měsíci jsou doporučovány kontroly každé 2 týdny a poté v měsíčním intervalu. Kombinace cyklosporinu A s methotrexatem je možná, zvyšuje však riziko imunosuprese.
Methotrexat
Methotrexat, analog kyseliny listové, je antimetabolit a je využíván k léčbě lupénky od r. 1958. Indikací je středně těžká a těžká forma psoriázy, psoritická artritida a pustulózní nebo erytrodermická forma lupénky. Mechanismus účinku methotrexátu spočívá v inhibici dihydrofolátreduktázy, která převádí kyselinu listovou v účinný faktor syntézy DNA. Konečným efektem této inhibice je zabránění vzniku tetrahydrofolátu a tím nepřímo zbrzdění syntézy nukleových kyselin a buněčného dělení. Právě inhibice syntézy DNA a RNA v aktivovaných T buňkách a v keratinocytech je zodpovědná za antipsoriatické účinky methotrexatu. Po perorálním podání dosahuje methotrexát max. plazmatické koncentrace za 1-2 hodiny, po i. m aplikaci během 30-60 minut. Aplikuje se jedenkrát týdně per os nebo parenterálně ( s.c. nebo i.m.). Pro perorální užívání může být dávka podána jednorázově nebo v 12hod intervalech během 24 až 36 hod. Druhá varianta by mohla snížit riziko nesnášenlivosti nebo vzniku nežádoucích účinků. Iniciální dávka by měla být 5-10mg/ týdně a může být zvýšena až do 30mg. V dermatologii většinou začínáme s dávkou 7,5mg, u starších lidí je vhodné začít v nižších dávkách 2,5 až 5mg/týdně. PASI 75 dosahuje 60% pacientů po 16 týdnech léčby. Kontraindikací k nasazení terapie jsou těžké infekce, těžká jaterní a renální insuficience, dysfunkce kostní dřeně, plicní fibróza, alkoholismus, imunodeficit, akutní žaludeční vřed a vzhledem k teratogenitě i těhotenství a laktace. Proto je před zahájením terapie potřeba pečlivě odebrat anamnézu a provést kompletní laboratorní vyšetření (KO+diff, jaterní enzymy, funkce ledvin, vyloučit hepatitidy, albumin, pokud možno PIIINP a RTG srdce a plic) a poučit pacienta o nutnosti abstinence. Musíme ale počítat s možnostmi vzniku nežádoucích reakcí, jako je suprese funkce kostní dřeně, jaterní toxicita, infekce, a proto je potřeba po prvním týdnu terapie zkontrolovat krevní obraz. Další kontroly jsou v prvních dvou měsících doporučené ve 2 týdenních intervalech a poté jednou za 2-3 měsíce. Pokud po perorálním podání vzniká nauzea a žaludeční dyskomfort, je možno přejít na parenterální formu. Nutno myslet i na interakce s jinými léky, např. s trimetoprimem, prebenecidem, retinoidy nebo nesteroidnimi antiflogistiky. Riziko hepatotoxicity se zvyšuje po dosazení kumulativní dávky 3g nebo při konzumaci alkoholu více než 100g týdně. Pro snížení rizika vzniku NÚ se doporučuje užívání kyseliny listové v dávce 5mg 24 hod před podáním methotrexatu, i když její pozitivní účinky jsou stále sporné. Ženy ve fertilním věku musí být řádně poučené o teratogenitě léku a nutnosti neotěhotnět během jeho podání a minimálně 6 měsíce po skončení terapie.
Acitretin
Acitretin je syntetický monoaromatický analog retinové kyseliny. Upravuje proliferaci, diferenciaci a keratinizaci epidermálních buněk. Moduluje též některé imunitní pochody např. redukci intraepidermalní migrace neutrofilů nebo indukci Th17 buněk vyvolanou interleukinem 6. Po perorálním podání dosahuje maximální plazmatickou koncentraci za 1-4 hodiny. 36 až 95% se vstřebává ve střevě. Doporučená denní dávka je 0,3-0,5 mg/kg během prvních 4 týdnů, poté se může zvýšit až na 0,8 mg/kg. PASI 75 dosahuje 25-75% pacientů. Tento velký rozdíl může být vysvětlen tím, že pacienti léčení acitretinem bývají často poddávkováni. Ke kontraindikacím patří renální a jaterní insuficience, ženy ve fertilním věku plánující rodinu do 2 let, těhotenství a laktace, hyperlipidemie, současné užívání kontraindikovaných léků (tetracyklinová antibiotika, phenytoin, vitamin A, methotrexat, antimykotika imidazolového typu), abusus alkoholu a dárcovství krve. Acitretin je teratogenní lék, a proto je nutné používání kontracepčních metod nejen během, ale i 2 roky po skončení terapie. Před nasazením terapie je nutno zkontrolovat krevní obraz, biochemii (jaterní a renální funkce, lipidy, glykemii) a u žen provést těhotenský test. Kontrola těchto parametrů by měla být každé 4 týdny během prvních 2 měsíců a poté jednou za dva měsíce. Mezi nežádoucí účinky patří hyperlipidemie, cheilitida, xeróza, defluvium, epistaxe, konjuktivitida a vzácněji zhoršení nočního viděni. Účinnost acitretinu se výrazně zvyšuje v kombinaci s fototerapií ( PUVA a UVB).
Biologická léčba
Adalimumab
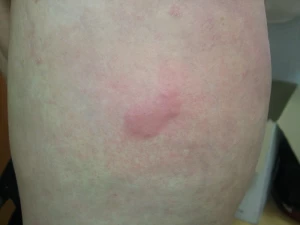
Adalimumab (Humira) je plně humánní monoklonální protilátka IgG1 proti TNF alfa. Váže s vysokou afinitou a specifitou solubilní i membránový TNFa (p55 a p75). Díky vazbě na membránový TNF alfa může vést ke komplementem indukované cytolýze. Aplikuje se subkutánně, iniciálně jednorázově 80 mg, po týdnu 40 mg a pak následuje aplikace 1x 40mg za 14 dnů. Klinický účinek ve studiích u pacientů s psoriázou nastupoval rychle a přetrvával až 3 roky. Z dosud provedených studií vyplývá, že odpověď na léčbu s PASI 75 dosáhlo v 16. týdnu 71 až 80% pacientů. Nežádoucí účinky byly mírné až střední intenzity (zejména infekce horních dýchacích cest, reakce v místě vpichu (obr. 3). Před nasazením adalimumabu, stejně jako u ostatních biologik, je nutno vyloučit maligní onemocnění, latentní TBC, hepatitidy nebo jiné infekce u rizikových pacientů.
Etanercept
Etanercept (Enbrel) je fúzní protein Fc fragmentu IgG1 a TNF alfa receptoru. Váže solubilní TNF alfa i beta a blokuje jeho interakci s povrchovými receptory. Aplikuje se 2 x týdně 25 mg subkutánně nebo 1 x týdně 50 mg nebo v indukční fázi prvních 12 týdnů, dávka může být zvýšena na 2 x týdně 50 mg. Oproti ostatním biologikům typu anti TNF-alfa má výhodu, že neindukuje tvorbu neutralizačních protilátek, a proto může být podání bezpečně přerušeno a opětovně zahájeno. Dle klinických studií 33 až 49 % pacientů dosáhne PASI 75 do 3 měsíců, účinnost však až do 6. měsíce léčby dále stoupá. Z nedávno zveřejněných výsledků studie Pristine vyplývá, že za použití intenzifikovaného režimu 2x50mg v prvních 12 týdnech a dále pak 1x50 mg spolu s lokální terapií dosáhne PASI 75 až 78 % pacientů.
Infliximab
Infliximab (Remicade) je chimérická monoklonální protilátka proti TNF alfa. Na rozdíl od ostatních biologik se aplikuje intravenózně v dávce 5 mg/kg nejprve po 2 týdnech, pak po 6 týdnech a dále každých 8 týdnů. Mezi výhody Infliximabu patří velmi rychlý nástup účinku, po 10 týdnech 80 % pacientů dosahuje PASI 75. Jisté limitace mohou být infuzní reakce (alergické reakce, třesavka, dekompenzace krevního tlaku) a délka podání (cca 2 hodiny).
Ustekinumab
Jak již bylo výše zmiňováno, kromě léků blokujících TNF alfa, jsou nyní k dispozici i látky blokující IL-12 a IL-23. V prosinci 2008 byl schválen nový biologický preparát Stelara (Ustekinumab) v Kanadě, v lednu 2009 v Evropě a v září 2009 ve Spojených státech.
Ustekinumab představuje první biologikum v nové třídě biologických léků, které cíleně inhibují účinek interleukinu IL-12 a IL-23. Jako ostatní biologika je indikován k léčbě středně závažné až závažné ložiskové formy psoriázy u dospělých pacientů, u kterých nebyla jiná systémová terapie, konkrétně retinoidy, cyklosporinem, metotrexátem nebo PUVou dostatečně účinná, případně je tato terapie kontraindikována nebo ji pacient netoleruje. Interleukiny IL-12 a IL-23 patří mezi klíčové regulátory v patogenezi psoriázy.
Ustekinumab je plně humanní monoklonální protilátka IgG1κ, která se váže specificky a s vysokou afinitou na podjednotku p40 proteinu cytokinu IL-12 a IL-23. Inhibuje jejich aktivitu tak, že zabraňuje těmto mediátorům navázat se na receptor (protein IL-12Rβ1), který je exprimován na povrchu imunitních buněk. IL-12 a IL-23 jsou heterodimerické cytokiny vylučované buňkami aktivovanými antigeny, jako jsou makrofágy a dendritické buňky, a podílejí se na imunitní odpovědi tím, že přispívají k aktivaci „přirozených zabíječů“ (NK, z angl. natural killer) buněk a k diferenciaci a aktivaci CD4+ T-buněk. Ustekinumab zabraňuje IL-12 a IL-23, aby se podílel na aktivaci imunitních buněk, a tím přerušuje signály a kaskády cytosinů, které jsou relevantní pro patogenezi psoriázy ve včasnější fázi než anti-TNF-alfa přípravky.
Podávání ustekinumabu je subkutánní, aplikuje se nejprve po 4 týdnech od prvního podání a dále jednou za 3 měsíce, což je velmi výhodné zejména pro pacienty, kteří dojíždí z daleka do centra biologické léčby. Pokud pacient váží do 100 kg, aplikuje se jedna injekce 45 mg, nad 100 kg jsou potřeba 2 injekce. Dle dosavadních klinických zkušeností je dávka 45 mg účinná i u pacientů nad 100 kg, ale zpravidla měsíc před aplikací další dávky dochází k postupnému zhoršení projevů psoriázy, proto se doporučuje dodržovat výše uvedené dávkováni. Odpověď PASI 75 byla dosažena při dávce 45 mg již po 12 týdnech (po 2 injekcích). Plný účinek léčby (PASI 75 dosaženo u 70 % – 79 % pacientů) byl v obou studiích III. fáze pozorován v 28. týdnu. Údaje jsou i o efektu na psoriatické nehty. V „head to head“ klinické studii s biologiky byl ustekinumab účinnější než etanercept. Při vysazení a opětovném nasazení léku nedochází ke ztrátě účinnosti a opakovaná léčba je rovněž účinná jako léčba počáteční. Tvorba protilátek se objevila u 5 % pacientů.
Dlouhodobá léčba zatím není spojená s významnými bezpečnostními riziky. Jako velmi časté se uvádějí infekce horních dýchacích cest a nasofaryngitida, dále především bolesti hlavy, svalů, průjem, pruritus a únava a jako méně časté reakce v místě vpichu.
Secukinumab
Secukinumab je nejnovější biologikum v léčbě psoriázy, které bylo schváleno EMEA v lednu 2015. Je to plně humánní monoklonální protilátka proti interleukinu (IL)-17A která selektivně suprimuje zánětlivou kaskádu indukovanou cytokinem IL-17A. Secukinumab prokázal účinnost a bezpečnost u středně závažné až závažné psoriázy. Secukinumab se aplikuje subkutánně každé 4 týdny 300mg s iniciační dávkou v týdnech 0,1,2,3, následovaný měsíční udržovací dávkou od týdne 4. Dle klinických studií 71% pacientů dosáhlo odpovědi PASI 90 po 16 týdnech léčby. Tuto odpověď si udrželo po roce léčby 63% pacientů. V léčbě psoriázy se jeví jako velmi slibné a posouvá reálnou cil zlepšeni PASI skóre z 75% na 90%.
Závěr
V 21. století máme několik možností, jak pomoci pacientům s lupénkou. Máme k dispozici lokální či systémové preparáty. I přes definované doporučené postupy (guidelines) ví každý lékař, který léčí pacienty s těžkou lupénkou, že je potřeba vždy zvažovat individuální přístup k nemocnému. Na takového pacienta nemůžeme pohlížet jen jako na nemocného s kožní chorobou, ale se systémovým onemocněním. Výzkum v oblasti dermatologie a konkrétně psoriázy se stále intenzivněji rozvíjí. V následujících letech nás čeká příchod i dalších preparátů, které budou přínosné nejen pro pacienta, ale i pro obor dermatovenerologie. Cílem terapie nemocného s těžkou lupénkou je snížit jeho PASI skóre v relativně krátké době alespoň o 75% - PASI 75. S příchodem nových preparátu bude reálné i dosažení PASI 90 tj., snížení PASI o 90% oproti výchozímu stavu.
Literatura u autora
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



