-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSartany v léčbě hypertenze
Datum publikace: 30. 10. 2016
1. Úvod
Angiotenzin II je klíčovou biologicky aktivní komponentou renin-angiotenzinového systému (RAAS) a prostřednictvím vazby na své receptory odpovídá za většinu periferních i centrálních účinků tohoto systému. Jde o významný regulátor krevního tlaku, sekrece aldosteronu, rovnováhy tekutin apod., přičemž je aktuálně označován za významný etiologický faktor pro rozvoj hypertenze a na ni navázaných dalších onemocnění kardiovaskulárního systému. Snahu o specifické ovlivnění jeho účinků na úrovni cílových receptorů je tak možné označit za racionální terapeutický přístup. Léčivé látky, které dnes za tímto účelem využíváme, označujeme jako sartany (syn. ARB).
Zavedení sartanů do klinické praxe v léčbě kardiovaskulárních onemocnění se datuje do poloviny 90. let, kdy prototyp této skupiny, losartan, byl v roce 1995 schválen americkým Úřadem pro potraviny a léčiva (FDA). Od té doby jsou sartany bohatě využívány v monoterapii nebo v kombinaci s jinými látkami (nejčastěji s hydrochlorothiazidem nebo některým z dihydropyridinových blokátorů kalciových kanálů) v léčbě esenciální arteriální hypertenze a u městnavého srdečního selhání.
2. Významní zástupci
Vedle dnes v klinické praxi využívaných sartanů (v České republice jsou aktuálně registrovány azilsartan-medoxomil, eprosartan, irbesartan, candesartan, losartan draselný, olmesartan-medoxomil, telmisartan a valsartan) jsou vyvíjeny i další molekuly ‒ např. embusartan, fonsartan, pratosartan, milfasartan aj. Všechny dnes užívané sartany s výjimkou eprosartanu mají ve svém molekule obsažený bifenyl. Pro losartan, irbesartan, olmesartan a eprosartan je typická přítomnost imidazolového substituentu. Tetrazolový kruh, jemuž byla původně přisuzována schopnost interakce s molekulami s cílovými receptory, je přítomný pouze u losartanu, candesartanu, olmesartanu a telmisartanu [1].
Níže jsou uvedeny chemické názvy (dle IUPAC) jednotlivých sartanů a jejich průměrná molekulová hmotnost:
Azilsartan-medoxomil (AZI)
- (5-methyl-2-oxo-2H-1,3-dioxol-4-yl)methyl 2-ethoxy-1-({4-[2-(5-oxo-4,5-dihydro-1,2,4-oxadiazol-3-yl)phenyl]phenyl}methyl)-1H-1,3-benzodiazole-7-carboxylat
- 568,5 g/mol
Eprosartan (EPR)
- ((E)-3[2-butyl-1-[(4-carboxy-phenyl)-methyl]-1H-imidazol-5-yl]-2-[(thienyl)methyl]propenoic acid
- 520,6 g/mol
Irbesartan (IRB)
- (2-butyl-3-[[2’-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]-1,3-diazaspiro[4.4]non-1en-4-one)
- 428,5 g/mol
Candesartan (KAN)
((1RS)-1-[[(cyclohexyloxy)carbonyl]-oxy]ethyl 2-ethoxy-1-[[2’-(1Htetrazol-5-yl)biphenyl-4-yl]methyl]-1H-benzimidazole-7-carboxylate)
- 610,7 g/mol
Losartan draselný (LOS)
- (potassium 5-[4’-[[2-butyl-4-chloro-5-(hydroxymethyl)-1H-imidazol-1-yl]methyl]biphenyl-2-yl]tetrazol-1-ide)
- 461 g/mol
Olmesartan-medoxomil (OLM)
- ((5-methyl-2-oxo-1,3-dioxol-4-yl)methyl 4-(1-hydroxy-1-methylethyl)-2-propyl-1-[[2’-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl]-1Himidazole-5-carboxylate)
- 558,6 g/mol
Telmisartan (TEL)
- (4’-[[4-methyl-6-(1-methyl-1Hbenzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]methyl]biphenyl-2-carboxylic acid)
- 514,6 g/mol
Valsartan (VAL)
- ((2S)-3-methyl-2-[pentanoyl[[2’-(1Htetrazol-5-yl)biphenyl-4-yl]methyl]amino]butanoic acid)
- 435,5 g/mol
3. Farmakologické vlastnosti
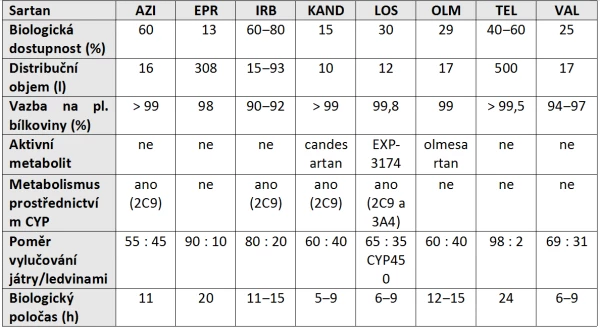
Byť popisované léčivé látky náleží do jedné lékové skupiny, výše zmíněné odlišnosti v jejich chemické struktuře předurčují jejich více či méně odlišné farmakokinetické (tabulka 1) a farmakodynamické vlastnosti. Candesartan, losartan a olmesartan jsou podávány jakožto proléčiva.
Mechanismus všech látek spočívá v antagonizaci angiotenzinových receptorů (AT1), přirozeně vázajících angiotenzin II. Dojde tak k zablokování přímé vazokonstrikce na straně jedné a na straně druhé se omezí tvorba aldosteronu v kůře nadledvin. Na rozdíl od inhibitorů ACE tak nezasahují do samotného katabolismu angiotenzinu a neovlivňují ani degradaci vazodilatačně působícího bradykininu. Odpovídající hodnoty disociačních konstant telmisartanu, olmesartanu, candesartanu, valsartanu a EXP3174 jsou 0,003248 min−1, 0,004171 min−1, 0,005203 min−1, 0,009946 min−1 a 0,008561 min−1. Tomu odpovídá nejvyšší vazebná afinita k AT1 receptorům v následujícím pořadí u telmisartanu, olmesartanu a candesartanu, nejnižší pak u losartanu [2]. Zatímco některé sartany zde působí kompetitivně (např. losartan), účinek jiných je nekompetitivní (např. candesartan). Právě nekompetitivní antagonismus je zdrojem déle trvající inhibice a pomalejší disociace [3]. Disociace je nejpomalejší u candesartanu, následovaná olmesartanem a telmisartanem [4]. V případě, že cílové receptory vykazují dostatečnou bazální aktivitu (mutace, up-regulace, …), mohou sartany působit rovněž jako inverzní agonisté [4]. Uváděná srovnání bohužel nezahrnovala molekulu azilsartanu, která je aktuálně prezentována jako látka s nejvyšší afinitou k AT1 receptorům (IC50: 7,4 nM) ve srovnání s telmisartanem (IC50: 191,6 nM), olmesartanem (IC50: 242,5 nM), irbesartanem (IC50: 10 000 nM) a valsartanem (IC50: > 10 000 nM) [5].
Tabulka 1: Základní farmakokinetické vlastnosti sartanů
4. Terapeutická účinnost
Terapeutická účinnost sartanů je podložena řadou klinických studií a jejich využití v léčbě esenciální arteriální hypertenze v první linii je zakotveno v řadě národních i mezinárodních doporučených terapeutických postupů vč. ESC/ESH z r. 2013 [6].
Při porovnání terapeutické účinnosti s inhibitory ACE je zřejmé, že sartany jsou srovnatelně účinné ve snižování krevního tlaku, redukci proteinurie a zabránění progrese renálních onemocnění. Zároveň příznivě ovlivňují morbiditu a mortalitu pacientů po infarktu myokardu a se srdečním selháním [6; 7].
S každou molekulou sartanů bylo provedeno několik klinických studií, v rámci kterých byla porovnávána jejich účinnost proti placebu nebo proti aktivnímu komparátoru z jiné lékové skupiny ‒ tabulka 2 sumarizuje nejvýznamnější z nich.
Tabulka 2: Přehled nejvýznamnějších klinických studií se sartany v indikaci esenciální arteriální hypertenze

Analýzou výsledků se lze dobrat ke čtyřem významným závěrům:
- Sartany účinně snižují hodnotu krevního tlaku.
- Sartany disponují daty o snížení rizika úmrtí u nemocných s hypertenzí (zejm. studie LIFE a ONTARGET).
- Sartany v léčbě esenciální arteriální hypertenze jsou noninferiorní inhibitorům ACE (studie ONTARGET).
- Sartany jsou účinná antihypertenziva, mj. i z důvodu nižšího rizika rozvoje diabetu (studie VALUE aj.) či CMP (např. studie LIFE).
Studie LIFE
Jde o nejvýznamnější klinickou studii porovnávající účinnost losartanu 50‒100 mg s kardioselektivním beta-blokátorem atenololem 50‒100 mg, přičemž v obou ramenech studie byl přidáván HCTZ, event. i jiné antihypertenzivum. Studie byla koncipována jako prospektivní a randomizovaná s dvojitým zaslepením a zapojilo se do ní 9 193 osob ve věku 55‒80 let s esenciální hypertenzí (průměrná hodnota TK vsedě: 160‒200/95‒115 mm Hg) a elektrokardiograficky potvrzenou hypertrofií levé komory. Jakkoliv bylo oběma přístupy dosaženo prakticky srovnatelného poklesu krevního tlaku, v případě losartanu byl zaznamenán nižší výskyt primárně hodnoceného kompozitního ukazatele, který byl definován jako CMP, IM a/nebo úmrtí z kardiovaskulární příčiny. Zatímco v rameni losartanu byl zaznamenán u 508 osob (23,8 případu na 1 000 osob/rok), u atenololu šlo o 588 osob (27,9 případu na 1 000 osob/rok) ‒ RR: 0,87 (p = 0,02). U nemocných léčených losartanem bylo méně případů úmrtí z kardiovaskulární příčiny (204 vs. 234; RR: 0,89; p = n. s.). Vysoce signifikantní rozdíl mezi oběma skupinami představoval výskyt fatální nebo nefatální cévní mozkové příhody ‒ 232 vs. 309 (RR: 0,75; p = 0,001) ‒ obrázek 1 [15].
Obrázek 1: Výskyt fatálních a nefatálních cévních mozkových příhod ve studii LIFE [15]
Dalším výrazným benefitem podávání sartanu v této studii byl nižší počet nově zaznamenaných případů diabetu, a to až o 25 % ve srovnání s podávání atenololu [14; 15].
Studie ONTARGET
Cílem studie ONTARGET bylo porovnání účinnosti ramiprilu (ACEI), telmisartanu (sartan) či jejich kombinace u pacientů s vaskulárním onemocněním či u diabetiků s vysokým rizikem. Studie byla koncipována jako randomizovaná prospektivní a dvojitě zaslepená. V první skupině (n = 8 576) byl podáván ramipril 10 mg/den, ve druhé telmisartan 80 mg/den (n = 8 542) a ve třetí obě dvě látky současně (n = 8 502). Primárním sledovaným kompozitním ukazatelem účinnosti byl výskyt úmrtí z kardiovaskulární příčiny, infarktu myokardu, cévní mozkové příhody či hospitalizace z důvodu srdečního selhání. Do studie vstoupilo 29 019 nemocných, randomizováno bylo 25 620. S mediánem 56 měsíců trvání studie byla hodnota krevního tlaku lehce nižší v obou skupinách léčených telmisartanem oproti ramiprilu samotnému, přičemž tento rozdíl setrval po celou dobu jejího trvání – o 0,9/0,6 mm Hg (telmisartan samotný) a o 2,4/1,4 mm Hg (kombinační léčba).
Primární endpoint byl pozorován u 1 412 nemocných v ramiprilové skupině (16,5 %) a u 1 423 (16,7 %) v telmisartanové skupině. Pacienti léčení ramiprilem měli vyšší výskyt kašle (4,2 vs. 1,1 %; p < 0,001), angioedému (0,3 % vs. 0,1 %; p = 0,01) a vyšší výskyt hypotenzních projevů (2,6 % vs. 1,7 %; p < 0,001). Výskyt synkop byl srovnatelný v obou skupinách (0,2 %). U nemocných léčených kombinací byl primární endpoint zaznamenán u 1 386 nemocných (16,3 %). V porovnání s ramiprilem zde byla výrazně vyšší pravděpodobnost hypotenzních projevů (4,8 % vs. 1,7 %; p < 0,001), synkop (0,3 % vs. 0,2 %; p = 0,03) či poruchy ledvinných funkcí (13,5 % vs. 10,2 %; p < 0,001). Účinnost sartanů a inhibitorů ACE v této indikaci je tedy možné hodnotit jako ekvivalentní, přičemž vzájemná kombinace nemocným nenabízí žádný další benefit, ba naopak [23].
Studie VALUE
Tato prospektivní klinická studie se snažila zodpovědět otázku, zdali valsartan snižuje kardiovaskulární morbiditu a mortalitu stejnou nebo odlišnou měrou nežli amlodipin u hypertoniků s vysokým kardiovaskulárním rizikem (n = 15 245). Krevní tlak v obou ramenech poklesl stejnou měrou a obdobně se bez významného rozdílu mezi oběma rameny studie snižovaly i ostatní sledované ukazatele. Překvapivě však ve prospěch sartanu svědčil výrazně nižší výskyt nových případů diabetu mellitu (p < 0,000 1) [22].
Z klinického pohledu je zajímavé porovnání účinku candesartanu s losartanem. V meta-analýze 13 randomizovaných klinických studií porovnávajících antihypertenzní účinky obou těchto látek, které byly publikovány v rozmezí let 1980 až 2008 s celkovým počtem 4 066 nemocných, byl prokázán výraznější účinek candesartanu, přičemž průměrný rozdíl v dosažených hodnotách krevního tlaku činil 3,22/2,21 mm Hg [24]. K analogickému závěru dospěli rovněž autoři o rok mladší metaanalýzy 12 randomizovaných klinických studií (n = 3 644), kteří hovoří o rozdílu vážených průměrů na úrovni 2,97/1,76 (p < 0,001). Pacienti užívající candesartan lépe reagovali na podanou léčbu a bylo snazší u nich dosáhnout cílové hodnoty krevního tlaku [25].
Další podpůrné významné klinické (nesartanové) studie
Studie ASCOT
Ačkoliv nejde o klinickou studii, ve které byla hodnocena účinnost sartanů, její výsledky jsou velmi významné z pohledu jasného průkazu terapeutického přínosu plynoucího z inhibice systému RAAS.
Šlo o randomizovanou prospektivní placebem kontrolovanou,multicentrickou studii, která se zabývala významem hypolipidemické terapie v primární prevenci u pacientů s hypertenzí a normální nebo jen lehce zvýšenou koncentrací cholesterolu. Do studie bylo zařazeno téměř 19 257 nemocných s hypertenzí ve věku 40–79 let a alespoň třemi kardiovaskulárními rizikovými faktory. Rozlišují se dvě části studie. V první, antihypertenzní větvi (ASCOT-BPLA – blood pressure lowering arm) byla zkoumána odezva krevního tlaku na podanou antihypertenzní léčbu, ve druhé, lipidové větvi (ASCOT-LLA – lipid lowering arm) byla navíc zkoumána otázka účinku hypolipidemické léčby. Léčebné režimy zahrnovaly 1/ blokátor kalciových kanálů amlodipin v denní dávce 5–10 mg plus nhibitor ACE perindopril dle potřeby (+ event. doxazosin GITS) anebo 2/ beta-blokátor atenolol (50‒100 mg denně) plus diuretikum bendroflumethiazid + kalium dle potřeby (+ event. doxazosin GITS). V průběhu studie (větev BPLA) se ukázalo, že terapie založená na kombinaci amlodipinu s perindoprilem představuje prokazatelně významnější kardiovaskulární ochranu než režim založený na atenololu, pročež byla s mediánem 5,5 roku sledování předčasně ukončena. Rozdíl mezi oběma rameny byl navzdory srovnatelnému poklesu krevního tlaku zaznamenán ve všech sekundárně sledovaných ukazatelích s výjimkou fatálního a nefatálního srdečního selhání. Šlo o nižší výskyt nefatálního IM či fatálně zakončené ICHS ( − 13 %), koronárních endpointů celkem ( − 13 %), kardiovaskulárních příhod a zákroků celkem ( − 16 %), snížení celkové ( − 11 %) i kardiovaskulární (ortality ( − 24 %) nižší výskyt fatálních a nefatálních cévních mozkových příhod ( − 23 %) ‒ obrázek 2. Jistě klinicky neméně důležité je i zjištění, že u nemocných léčených kombinací amlodipinu s nhibitorem ACE byl nižší výskyt nově zaznamenaných případů diabetu ‒ pokles o 30 % ‒ obrázek 3 [26].
Obrázek 2: Výskyt fatálních a nefatálních infarktů ve studii ASCOT [26]
Obrázek 3: Výskyt nových případů diabetu mellitu ve studii ASCOT [26]
Studie ACCOMPLISH
Studie ACCOMPLISH dokresluje význam kombinační léčby inhibitorem RAAS s amlodipinem [27].
Studie byla multicentrická (548 klinických pracovišť), randomizovaná, dvojitě zaslepená a zúčastnilo se jí 11 506 pacientů trpících hypertenzí, u kterých bylo současně zjištěno vysoké riziko rozvoje kardiovaskulárních příhod. Po randomizaci do dvou skupin byla nemocným podávána buď kombinace benazeprilu 20 mg a amlodipinu 5 mg (skupina 1; n = 5 744), anebo kombinace benazeprilu v téže dávce a hydrochlorothiazidu 12,5 mg (skupina 2; n = 5 762). V obou skupinách byla dle protokolu dávka benazeprilu po 1. měsíci zvýšena na 40 mg. Následně mohli investigátoři provést i zdvojnásobení výše dávek obou zbylých sledovaných látek s cílem dosažení hodnot krevního tlaku pod 140/90 mm Hg (v případě diabetiků či pacientů s onemocněním ledvin pod 130/80 mm Hg). Přidání jiného antihypertenziva bylo ve studii povoleno (vyjma blokátorů vápníkového kanálu, inhibitorů ACE, sartanů a thiazidových diuretik).
Ačkoliv ani v této studii nebylo mezi oběma porovnávanými přístupy dosaženo jakkoliv klinicky relevantního rozdílu v dosaženém poklesu krevního tlaku, studie byla předčasně ukončena v průměrné délce sledování 36 měsíců z důvodu zřejmé superiority kombinace BKK + inhibitor RAAS v ostatních sledovaných ukazatelích. Zatímco výskyt primárního ukazatele (doba do objevení se příhody definované jako kardiovaskulární příhoda a úmrtí z kardiovaskulárních příčin) byl v 1. skupině zaznamenán u 552 nemocných, ve 2. skupině až u 679 (9,6 vs. 11,8 %; HR: 0,80; p < 0,001). Počet příhod přepočtený na 1 000 pacientoroků tak činil 32,3 vs. 39,7. Analogické výsledky se týkaly i sekundárního endpointu (úmrtí z kardiovaskulární příčiny + nefatální infarkt myokardu a nefatální cévní mozkové příhody), a sice 288 a 364 případů (5,0 vs. 6,3 %; HR: 0,79; p = 0,002), či výlučně kardiovaskulárních příhod – 494 vs. 592 (8,6 vs. 10,3; HR: 0,83; p = 0,002).
U nemocných užívajících kombinaci benazeprilu s amlodipinem byl zjištěn i nižší výskyt fatálních i nefatálních infarktů myokardu (relativní snížení rizika: 21,5 %; p = 0,04) a nižší výskyt případů revaskularizace koronárních tepen (relativní snížení rizika: 13,9 %; p = 0,04). Počet hospitalizací z důvodu městnavého srdečního selhání byl mezi oběma skupinami srovnatelný – 1,7 % (HR: 1,04; p = 0,77). Za předpokladu připočtení případů hospitalizace k primárnímu kompozitnímu endpointu byl rozdíl mezi skupinami velmi signifikantní – 10,7 vs. 12,8 % (HR: 0,83; p < 0,001). Počet resuscitací z důvodu náhlé srdeční zástavy nebyl mezi skupinami signifikantně odlišný (p = 0,20) [27].
5. Bezpečnost a snášenlivost
Sartany disponují oproti inhibitorům ACE příznivějším bezpečnostním profilem (nižší výskyt suchého kašle), od kterého lze odvodit vyšší adherenci. K častěji uváděným nežádoucím účinkům lze jistě přiřadit hyperkalémii (důsledek sníženého uvolňování aldosteronu), hypotenzi a ortostatickou hypotenzi (zejm. v iniciálních fázích léčby). Další zaznamenané nežádoucí účinky zahrnují nejrůznější ostatní NÚ (např. únavu, vertigo, hyperbilirubinémii, akutní selhání ledvin a mnohé další), svojí četností se však řadí k méně častým.
Nedávno vznesená otázka možné asociace mezi užíváním sartanů a rizikem rozvoje nádorového bujení se ukázala být lichou, a to jak ve vztahu k celkovému riziku rakoviny, tak i k jednotlivým sledovaným typům nádorů [28]. Viz rovněž přehledná informace na stránkách FDA ‒ http://www.fda.gov/Drugs/DrugSafety/ucm257516.htm.
Zmiňovaný příznivý bezpečnostní profil a vztah k adherenci byly jasně demonstrovány v populační italské studii s kohortou hypertoniků (n = 445 356) ve věku 40‒80 let od autorského kolektivu Corrao et al. Ten adherenci k sartanům uvádí dokonce jako nejlepší ve srovnání i s ostatními základními třídami antihypertenziv ‒ oproti inhibitorům ACE byla vyšší při užívání sartanů (HR: 0,92; 95% CI: 0,90‒0,94) a naopak výrazně nižší např. u beta-blokátorů (HR: 1,64; 95% CI: 1,62‒1,67) [29].
6. Lékové interakce
Všem sartanům vlastní zvýšené riziko hyperkalémie představuje hlavní platformu pro lékové interakce. Jde zejména o vzájemně potenciační hyperkalemizující účinek s kalium šetřícími diuretiky, přípravky určenými k suplementaci kalia nebo např. heparinu. Lze tedy i předpokládat výsledně snížený účinek současně podaného digoxinu. Na straně druhé je riziko hyperkalémie snižováno až eliminováno při současném podávání kalium nešetřících diuretik.
Antihypertenzní účinek sartanů, analogicky jako je tomu u ostatních antihypertenziv, může být snížen současným užíváním nesteroidních antiflogistik, kortikosteroidů, hormonálních kontraceptiv a případně dekongestiv působících stimulaci alfa1-adrenergních receptorů. Pravděpodobně z důvodu navození poklesu glomerulární filtrace může dojít ke sníženému vylučování lithia (doporučuje se jeho monitorace). Významné farmakokinetické lékové interakce dosud nebyly zaznamenány, byť např. hydrochlorothiazid mírně zvyšuje biologickou dostupnost candesartanu [30].
7. Kontraindikace
Vedle známé přecitlivělosti na účinnou látku nebo látku chemicky příbuznou nesmí být sartany podávány těhotným, osobám s hyperkalémií a nemocným s bilaterální stenózou ledvinných tepen. U žen ve fertilním věku se při jejich nasazení doporučuje současné užívání účinné kontracepce.
8. Užívání u vybraných skupin nemocných
Těhotné ženy
Užívání kteréhokoliv ze sartanů je během gravidity absolutní kontraindikací s ohledem na jejich teratogenní potenciál. Poukazováno je především na teratogenicitu ve 2. a 3. trimestru, analogicky jako je tomu u inhibitorů ACE (riziko selhání ledvin, dysplazie ledvin, oligohydramnion, hypoplazie plic či hypocalvarie); negativní účinky v 1. trimestru jsou spíše přisuzovány hypoperfuzi placenty [31].
Kojící ženy
Vzhledem k nedostatku informací týkajících se bezpečnosti není podávání těchto látek během kojení doporučeno.
Nemocní se selhávajícími ledvinami (L) nebo játry (J) a senioři (S)
- azilsartan
- L ‒ u lehkého až středně těžkého selhání není třeba úprava dávky, dále je doporučována opatrnost
- J ‒ u lehké až středně těžké formy se doporučuje iniciálně dávka 20 mg/den, u těžké formy se užívání nedoporučuje
- S ‒ úprava dávky není nutná, u osob nad 75 let iniciálně volit dávku 20 mg/den
- candesartan
- L ‒ doporučeno užití dávky 4 mg
- J ‒ u mírné až středně těžké formy se doporučují iniciálně pouze 4 mg; kontraindikací je těžké selhání a cholestáza
- S ‒ úprava dávky není nutná
- eprosartan
- L ‒ u nemocných se středně těžkou až těžkou formou by denní dávka neměla překročit 600 mg
- J ‒ k dispozici pouze omezené klinické zkušenosti
- S ‒ úprava dávky není nutná
- irbesartan
- L ‒ úprava dávky není uváděna; u osob na dialýze je třeba dávku ponížit
- J ‒ úprava dávky není uváděna
- S ‒ doporučeno iniciálně podat 75 mg/den
- losartan
- L ‒ potřeba úpravy dávky není uváděna u mírné až středně těžké formy
- J ‒ kontraindikací je těžké selhání, v ostatních případech je uváděno doporučení zvážení užití nižší dávky
- S ‒ doporučeno zvážit zahájení léčby dávkou 25 mg
- olmesartan
- L ‒ u lehké až středně těžké formy je doporučováno max. 20 mg/den, u těžkého selhání se užívání nedoporučuje
- J ‒ u středně těžké formy se doporučuje iniciálně pouze 10 mg (max. 20 mg/den), u těžké formy se nedoporučuje; kontraindikací je obstrukce žlučových cest
- S ‒ úprava dávky obvykle není nutná (při užívání vyšších dávek je třeba pečlivěji monitorovat krevní tlak)
- telmisartan
- L ‒ u lehkého až středně těžkého selhání není třeba úprava dávky, u těžké formy je třeba volit nižší iniciální dávku
- J ‒ kontraindikace u závažné insuficience, u lehce až středně snížené funkce doporučení dávky max. 40 mg/den
- S ‒ úprava dávky není nutná
- valsartan
- L ‒ potřeba úpravy dávky u GFR > 10 ml/min není uváděna
- J ‒ kontraindikace u závažné insuficience, biliární cirhózy a cholestázy; u lehce až středně snížené funkce doporučení dávky max. 80 mg/den
- S ‒ úprava dávky není nutná
9. Postavení sartanů v aktuálních doporučených postupech
Sartany patří mezi antihypertenziva 1. linie. Dle novelizovaných doporučených diagnostických a terapeutických postupů pro všeobecné praktické lékaře (r. 2014) jsou v souladu s výše uváděným doporučením ESC/ESH z r. 2013 [6] vhodné pro všechny typy hypertenze s výjimkou hypertenze v těhotenství. Jakkoliv se řadí mezi nejbezpečnější antihypertenziva, během jejich užívání je doporučováno sledování plazmatických hladin kalia, urey a kreatininu.
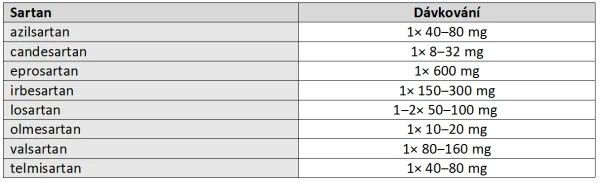
Doporučené dávkování jednotlivých zástupců zachycuje tabulka 3:
Tabulka 3: Doporučené dávkování jednotlivých zástupců skupiny sartanů
Dalšími indikacemi sartanů jsou:
- diabetická a nediabetická nefropatie,
- hypertrofie levé srdeční komory,
- systolická dysfunkce levé komory,
- městnavé srdeční selhání,
- st. p. IM,
- fibrilace síní (?),
- suchý kašel při užívání inhibitorů ACE.
- Muszalska I., Sobczak A., Dolhan A., Jelinska A. Analysis of Sartans: a review. J Pharm. Sci. 2014; 103: 2–28.
- Kakuta H., Sudoh K., Sasamata M., Yamagishi S. Telmisartan has the strongest binding affinity to angiotensin II type 1 receptor: comparison with other angiotensin II type 1 receptor blockers. Int J Clin Pharmacol Res 2005; 25: 41–46.
- Vauquelin G., Fierens F., Van L. I. Long-lasting angiotensin type 1 receptor binding and protection by candesartan: comparison with other biphenyl-tetrazole sartans. J Hypertens. Suppl 2006; 24: S23–S30.
- Van L. I., Vauquelin G. Sartan-AT1 receptor interactions: in vitro evidence for insurmountable antagonism and inverse agonism. Mol Cell Endocrinol. 2009; 302: 237–243.
- Kurtz T. W., Kajiya T. Differential pharmacology and benefit/risk of azilsartan compared to other sartans. Vasc. Health Risk Manag. 2012; 8: 133–143.
- Mancia G., Fagard R., Narkiewicz K. et al. 2013 ESH/ESC Practice Guidelines for the Management of Arterial Hypertension. Blood Press 2014; 23: 3–16.
- Burnier M., Vuignier Y., Wuerzner G. State-of-the-art treatment of hypertension: established and new drugs. Eur Heart J 2014; 35: 557–562.
- Ogihara T., Fujimoto A., Nakao K., Saruta T. ARB candesartan and CCB amlodipine in hypertensive patients: the CASE-J trial. Expert. Rev Cardiovasc. Ther 2008; 6: 1195–1201.
- Barnett A. H., Bain S. C., Bouter P. et al. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl. J Med 2004; 351: 1952–1961.
- Kasanuki H., Hagiwara N., Hosoda S. et al. Angiotensin II receptor blocker-based vs. non-angiotensin II receptor blocker-based therapy in patients with angiographically documented coronary artery disease and hypertension: the Heart Institute of Japan Candesartan Randomized Trial for Evaluation in Coronary Artery Disease (HIJ-CREATE). Eur Heart J 2009; 30: 1203–1212.
- Lewis E. J., Hunsicker L. G., Clarke W. R. et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl. J Med 2001; 345: 851–860.
- Mochizuki S., Dahlof B., Shimizu M. et al. Valsartan in a Japanese population with hypertension and other cardiovascular disease (Jikei Heart Study): a randomised, open-label, blinded endpoint morbidity-mortality study. Lancet 2007; 369: 1431–1439.
- Sawada T., Yamada H., Dahlof B., Matsubara H. Effects of valsartan on morbidity and mortality in uncontrolled hypertensive patients with high cardiovascular risks: KYOTO HEART Study. Eur Heart J 2009; 30: 2461–2469.
- Dahlof B., Devereux R., de FU et al. The Losartan Intervention For Endpoint reduction (LIFE) in Hypertension study: rationale, design, and methods. The LIFE Study Group. Am. J Hypertens. 1997; 10: 705–713.
- Dahlof B., Devereux R. B., Kjeldsen S. E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359: 995–1003.
- Schrader J., Luders S., Kulschewski A. et al. Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principal results of a prospective randomized controlled study (MOSES). Stroke 2005; 36: 1218–1226.
- McMurray J. J., Holman R. R., Haffner S. M. et al. Effect of valsartan on the incidence of diabetes and cardiovascular events. N Engl. J Med 2010; 362: 1477–1490.
- Yusuf S., Diener H. C., Sacco R. L. et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl. J Med 2008; 359: 1225–1237.
- Brenner B. M., Cooper M. E., de ZD et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl. J Med 2001; 345: 861–869.
- Lithell H., Hansson L., Skoog I. et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J Hypertens. 2003; 21: 875–886.
- Yusuf S., Teo K., Anderson C. et al. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet 2008; 372: 1174–1183.
- Julius S., Kjeldsen S. E., Weber M. et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004; 363: 2022–2031.
- Yusuf S., Teo K. K., Pogue J. et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl. J Med 2008; 358: 1547–1559.
- Meredith P. A., Murray L. S., McInnes G. T. Comparison of the efficacy of candesartan and losartan: a meta-analysis of trials in the treatment of hypertension. J Hum. Hypertens. 2010; 24: 525–531.
- Zhenfeng Z., Huilan S., Junya J., Dong L., Shan L. A systematic review and meta-analysis of candesartan and losartan in the management of essential hypertension. J Renin. Angiotensin. Aldosterone. Syst. 2011; 12: 365–374.
- Dahlof B., Sever P. S., Poulter N. R. et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366: 895–906.
- Jamerson K., Weber M. A., Bakris G. L. et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl. J Med 2008; 359: 2417–2428.
- ARB Trialists collaboration. Effects of telmisartan, irbesartan, valsartan, candesartan, and losartan on cancers in 15 trials enrolling 138,769 individuals. J Hypertens. 2011; 29: 623–635.
- Corrao G., Zambon A., Parodi A. et al. Discontinuation of and changes in drug therapy for hypertension among newly-treated patients: a population-based study in Italy. J Hypertens. 2008; 26: 819–824.
- Jonkman J. H., van Lier J. J., van Heiningen P. N., Lins R., Sennewald R., Hogemann A. Pharmacokinetic drug interaction studies with candesartan cilexetil. J Hum. Hypertens. 1997; 11 Suppl 2: S31–S35.
- Quan A. Fetopathy associated with exposure to angiotensin converting enzyme inhibitors and angiotensin receptor antagonists. Early Hum. Dev. 2006; 82: 23–28.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



