-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaUlcerózní kolitida
Datum publikace: 3. 5. 2021
Idiopatické střevní záněty (IBD – inflammatory bowel diseases), mezi něž patří Crohnova nemoc (CN) a ulcerózní kolitida (UC), se za posledních několik desetiletí dostávají stále více do povědomí běžné populace a čím dál větší pozornost je jim věnována i mezi odborníky, tedy gastroenterology. Tento trend je spojen především s narůstajícím výskytem těchto onemocnění, a to ve společnosti celkově (zejména v západní populaci), ale i z hlediska časté manifestace v dětském či mladším věku. V souvislostí s tím dochází k turbulentnímu vývoji jak v oblasti diagnostiky, tak také v oblasti nových léčebných postupů a možností.
Definice
Ulcerózní kolitida (UC) je hemoragicko-katarální zánět sliznice tlustého střeva postihující rektum a šířící se kontinuálně na různě rozsáhlou část tlustého střeva. Medikamentózně je nevyléčitelná, probíhá chronicky a charakteristické je pro ni střídání období remisí a relapsů.
Incidence a prevalence
Incidence a prevalence IBD se v poslední 20 letech celkem výrazně mění. Nejvyšší prevalence je zaznamenána v zemích s vysoce rozvinutou ekonomikou, např. v západní a severní Evropě, USA, Kanadě a Austrálii. Uplatňuje se zejména tzv. severo-jižní a východo-západní gradient. Celosvětová prevalence IBD se v letech 1990–2017 zvýšila o 31 %.
V Česku se prevalence UC pohybuje kolem 200–250/100 000 obyvatel (podle údajů ÚZIS MZ ČR z roku 2018) a incidence je odhadována na 3,1–4,9/100 000 obyvatel (podle dat z GBD – Global Burden of Diseases). Řadíme se tedy mezi státy s vysokou prevalencí této choroby.
Medián výskytu onemocnění je zpravidla dvouvrcholový, první peak se dostavuje v mladším věku, mezi 20. a 30. rokem, druhý mezi 50. a 60. rokem. O trochu častěji UC postihuje ženské pohlaví. Byly taktéž pozorovány rozdíly mezi etniky, např. vyšší prevalence mezi aškenázskými Židy, naopak vzácný je výskyt onemocnění u nebělochů v rozvojových zemích.
Epidemiologie a patogeneze
V současné době jsou již známy mnohé z patogenetických mechanismů působících při rozvoji UC, nicméně přesná etiopatogeneze UC zůstává nejasná, onemocnění má multifaktoriální charakter. Aktuálně akceptovanou teorie zní, že vlivem určitých (dosud ne zcela známých) faktorů zevního prostředí dojde u geneticky predisponovaného jedince k rozvoji nepřiměřené odpovědi imunitního systému na střevní mikroflóru a následnému poškození střeva a vzniku chronického onemocnění.
Dosud bylo identifikováno několik environmentálních faktorů, jež by se na vzniku UC mohly podílet. Některé byly opakovaně potvrzeny v několika studiích, o významu jiných se však stále diskutuje.
Kouření
Jedním z nejpopsanějších rizikových faktorů je kouření. U pacientů s UC má protektivní význam. Studie prokázaly, že aktivní kouření snižuje riziko vzniku UC, zatímco bývalí kuřáci mají naopak incidenci UC zvýšenou (riziko vzniku je u nich asi 1,7× vyšší než u lidí, kteří nikdy nekouřili). Aktivní kuřáci s UC mají rovněž příznivější průběh nemoci, s nižším počtem hospitalizací. Nicméně léčebné využití je samozřejmě kontraindikované pro mnohá rizika, zejména kardiovaskulární a onkologická. Přesný patofyziologický mechanismus dopadu kouření na IBD není znám, předpokládají se modulační účinky na humorálně a buněčně zprostředkované imunitní mechanismy.
Apendektomie
V několika studiích byla jako protektivní faktor vzniku UC popsána apendektomie pro apendicitidu, zejména v mladším věku. Některé práce navíc naznačují modulační efekt tohoto zákroku na průběh UC ve smyslu méně závažného průběhu onemocnění. Přesná etiopatogenetická souvislost mezi apendicitidou a rizikem vzniku UC ovšem není známa. Předpokládá se, že je způsobena různými imunitními mechanismy zapojenými do těchto dvou onemocnění.
Bakterie a infekce
Po desetiletí jsou zkoumány různé mikroorganismy jako možná příčina vzniku IBD, žádný z nich však pravděpodobně není etiologickým agens. Aktivita mikrobiálních kmenů však může způsobovat dysbiózu, čímž je ovlivněna metabolická aktivita enterocytů a kolonocytů, která může vést k rozvoji UC. Potenciální role bakterií také vedla ke značnému zájmu o prebiotickou a probiotickou léčbu UC. Zdá se, že časná expozice běžným mikrobům v prostředí může být jakousi prevencí proti vzniku UC, jako je tomu u jiných autoimunitních poruch (v souladu s tzv. hygienickou hypotézou).
Strava
Bylo identifikováno několik složek potravy, které by mohly zvyšovat riziko na vznik IBD (ω-6 polynenasycené mastné kyseliny, zvýšený příjem živočišných bílkovin a příjem dietního cukru) nebo před ním naopak chránit (ω-3 polynenasycené mastné kyseliny, středomořská strava). Výsledky jednotlivých studií jsou však značně nekonzistentní, pravděpodobně z důvodu různorodých metodologických nedostatků jednotlivých výzkumů.
Dědičnost
Nejsilnějším z dosud známých dosud známých rizikových faktorů vzniku IBD je pozitivní rodinná anamnéza. Nicméně přesto jen 10–25 % pacientů s UC má mezi příbuznými 1. stupně další osobu s UC a u naprosté většiny nemocných se jedná o sporadický výskyt. Ve srovnání s CN je význam genetické predispozice pro vznik UC menší a významnější roli hrají faktory zevního prostředí.
Pokud má jeden rodič IBD, riziko vzniku IBD u potomka je 3–8× vyšší (podle typu IBD u rodiče) oproti zdravé populaci. Nicméně absolutní riziko vzniku IBD u potomka pacienta s touto nemocí je relativně nízké a pohybuje se kolem 3 %. Jiná situace však nastává, pokud oba rodiče trpí IBD; pak je absolutní riziko vzniku nemoci pro potomka vysoké a pohybuje se okolo 30 %.
Klasifikace UC
Onemocnění postihuje rektum a může se kontinuálně šířit na proximální část tračníku v různém rozsahu. Pro klasifikaci UC podle maximální extenze zánětu se v současné době používá tzv. Montrealská klasifikace, na jejímž základě dělíme UC na 3 typy: proktitida (E1), levostranná kolitida (E2) a extenzivní kolitida (E3) (viz tab. 1).
Lokalizace UC je závislá na věku v době diagnózy. Extenzivní UC se nejčastěji vyskytuje u mladých pacientů (do 18 let věku), ve věku 18–59 let je nejtypičtější proktitida a levostranný typ se nejčastěji vyskytuje u nemocných starších 60 let. V čase může docházet ke změně extenze zánětu. Až u zhruba třetiny pacientů dochází v průběhu 10 let od diagnózy k progresi UC do extenzivnějších forem (lokalizace E1 → E2/E3 a E2 → E3). Postižení sliznice je difuzní, na rozdíl od CN není postiženo tenké střevo. Výjimkou je tzv. backwash ileitida, kdy je zánět rozšířen i do krátkého úseku terminálního ilea (v rozsahu max. do 10–15 cm), bez přítomnosti vředů a stenóz. K tomuto postižení může dojít u pacientů s těžším průběhem UC a extenzivním postižením tlustého střeva.
Tab. 1 Montrealská klasifikace rozsahu UC
Rozsah Anatomická lokalizace E1 – proktitida postižení rekta (proximální postižení maximálně k rektosigmoideálnímu spojení) E2 – levostranný typ postižení rekta a tračníku maximálně k lienální flexuře E3 – extenzivní postižení postižení tračníku pokračuje orálně nad lienální flexuru Extraintestinální manifestace
Mimostřevní projevy se u UC mohou vyskytnout až u 1/5 pacientů (7–21 %), což je o něco méně často než v případě CN. Můžeme je rozdělit na závislé na aktivitě střevního zánětu a na této aktivitě nezávislé.
Artropatie
Velmi častou extraintestinální manifestací (EIM) UC je postižení kloubů. Artropatie dle lokalizace dělíme na axiální a periferní. Mezi periferní řadíme například artritidu, entezitidu (viz obr. 1), daktylitidu a artralgie. Periferní artritidy jsou na rozdíl třeba od revmatoidní artritidy neerozivní a nedeformující. Axiální artropatie zahrnují izolovanou sakroileitidu a ankylozující spondylitidu (AS), s postižením periferních kloubů nebo bez něj.
Obr. 1 Entezitida
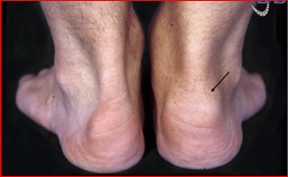
Periferní artropatie
Periferní artropatie se dále rozdělují na 2 typy, a to podle charakteru kloubního postižení a vazby na střevní aktivitu. Typ I je pauciartikulární a typicky postihuje < 5 velkých kloubů, obvykle na dolních končetinách; častá je asymetrická lokalizace. Tento typ artropatie je spojen s aktivitou střevního zánětu.
Typ II je charakterizován symetrickou a polyartikulární lokalizací (> 5 kloubů), obvykle jsou postižené malé klouby horních končetin. Průběh tohoto typu EIM je nezávislý na aktivitě UC a může přetrvávat měsíce až roky.
Axiální artropatie
Izolovaná sakroiliitida (viz obr. 2) je uni - či bilaterální zánět sakroiliakálních kloubů, který má často asymptomatický průběh nebo se projevuje zánětlivou bolestí dolní části zad. U části pacientů (obvykle u HLA-B27-pozitivních jedinců) může progredovat do vzniku AS, s udávanou prevalencí mezi pacienty s IBD 1–10 %. Průběh těchto EIM je nezávislý na aktivitě střevního zánětu.
V diagnostice těchto onemocnění je v současné době zlatým standardem magnetická rezonance (MRI). Díky ní může být zánět odhalen dříve, než se objeví kostní postižení viditelné na prostém rentgenovém snímku. Cílem léčby artritidy spojené s UC je redukce zánětu a zmírnění bolesti.
Obr. 2 Izolovaná sakroiliitida
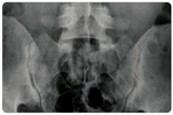
Pacienti mohou profitovat z podávání sulfasalazinu, eventuálně systémových kortikosteroidů (KS). Pro zmírnění bolestí lze podávat NSAIDs. Na rozhodnutí o léčbě axiální artropatie by se měl spolupodílet revmatolog. U pacientů s aktivní AS refrakterní na NSAIDs nebo s intolerancí NSAIDs se doporučuje anti-TNF terapie.
Kožní projevy
Erythema nodosum
Jedná se o panikulitidu (zánět podkožní tukové tkáně), která se makroskopicky projevuje výsevem obvykle vícečetných citlivých až bolestivých nodulů tmavě červené barvy (viz obr. 3), typicky na kůži extenzorů dolních končetin, zejména na přední tibiální oblasti a na hleznech, vzácně též na stehnech nebo pažích. Erythema nodosum se kromě IBD vyskytuje i u řady jiných zánětlivých či nezánětlivých stavů a onemocnění. U IBD velmi úzce souvisí s aktivitou střevního onemocnění. Léčba spočívá v intenzifikaci nebo úpravě systémové protizánětlivé terapie.
Obr. 3 Erythema nodosum
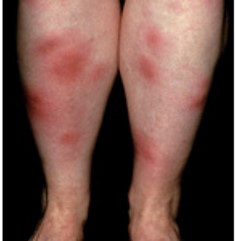
Pyoderma gangrenosum
Toto zánětlivé onemocnění kůže se řadí mezi neutrofilní dermatózy a projevuje se vznikem bolestivých ulcerací (viz obr. 4). Vyskytuje se u 0,6–2,1 % pacientů s UC. U 20–30 % pacientů vzniku kožní léze předchází trauma a porušení kožního krytu, tento jev je známý jako tzv. pathergie. Vředy mohou být solitární nebo mnohočetné, uni - či bilaterální a různého rozsahu (několik cm až postižení celé končetiny). Nejčastěji se pyoderma gangrenosum vyskytuje na končetinách nebo na trupu, specifická lokalizace je v okolí (ileo-/kolo)stomie. Souvislost s aktivitou střevního onemocnění je kontroverzní.
1. linii léčby představují KS (lokální a/nebo systémové). Pokud na jejich podávání léze nereaguje, měla by být zvážena anti-TNF terapie. Léčebný postup je případně vhodné konzultovat s dermatologem.
Obr. 4 Pyoderma gangrenosum
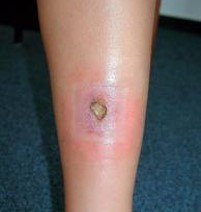
Oční projevy
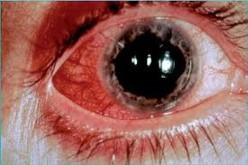
Oční EIM zahrnují dva projevy, episkleritidu (viz obr. 5) a uveitidu.
Episkleritida je zánět mezi spojivkou a sklérou, zpravidla souvisí s aktivitou UC. Obvykle dobře reaguje na terapii lokálními KS a NSAIDs, může i spontánně odeznět.
Uveitida je zánětlivé postižení živnatky (uvea + tunica vasculosa). Uvea je vysoce vaskularizovaná vrstva oka, jež má 3 části: choroidea (cévnatka), corpus ciliare (řasnaté těleso) a iris (duhovka). Uveitida je často bilaterální a má potenciálně závažnější následky než episkleritida.
Kvůli možné progresi a riziku případné ztráty zraku by pacient měl být okamžitě odeslán ke specialistovi. Léčba obvykle spočívá v podávání lokálních či systémových KS a/nebo NSAIDs. Imunosupresivní léčba, eventuálně anti-TNF terapie jsou indikované v případě rezistence.Obr. 5 Episkleritida
Hepatobiliární komplikace
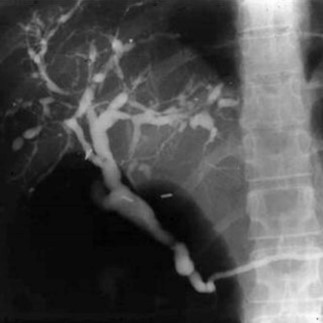
Nejčastějším hepatobiliárním onemocněním asociovaným s IBD je primární sklerozující cholangitida (PSC) (viz obr. 6), která patří mezi nejzávažnější komplikace u pacientů s IBD. Odhaduje se, že zhruba 70–80 % pacientů s PSC má souběžně IBD, častěji UC. Naopak pouze asi u 5 % pacientů s UC se v průběhu života vyvine PSC. PSC je hlavním rizikovým faktorem pro vznik karcinomu jak cholangiocelulárního, tak kolorektálního (KRK).
Základní diagnostickou metodou u pacientů s podezřením na PSC je magnetickorezonanční cholangiopankreatografie (MRCP). Endoskopická retrográdní cholangiopankreatografie (ERCP) zůstává pouze terapeutickou metodou, a to pro zvládnutí významných biliárních stenóz. Při farmakoterapii lze použít kyselinu ursodeoxycholovou (UDCA), která sice normalizuje hladiny jaterních enzymů a snižuje riziko KRK, ale neovlivňuje prognózu samotné PSC. U pokročilého onemocnění se selháním jater je jedinou možností léčby transplantace. V případě diagnózy PSC u pacientů s IBD jsou v rámci dispenzarizace indikovaná tato vyšetření: kolonoskopie 1× ročně, MRCP 1× ročně, UZ jater 1× za 6 měsíců.
Obr. 6 Obraz PSC při zobrazovacím vyšetření
Klinický obraz
Příznaky UC závisejí na rozsahu a tíží zánětu a zahrnují průjmy, krvácení z konečníku, evakuaci hlenu (někdy i bez stolice), urgence a tenesmy. Tenesmy jsou typickým příznakem u pacientů s proktitidou, jedná se o pocit nedostatečného či neúplného vyprázdnění s imperativním nucením na stolici, často doprovázený bolestí v podbřišku. Může docházet i k přechodné fekální inkontinenci.
Akutní (těžká) ulcerózní kolitida
ASUC (acute severe ulcerative colitis) je velmi závažný stav, který vyžaduje urychlenou hospitalizaci a intenzivní parenterální medikamentózní terapii. Komplikuje průběh léčby asi u 20–30 % pacientů. Je vyvolána těžkými zánětlivými změnami. Definována je jako ≥ 6 krvavých stolic za den s minimálně 1 projevem systémové zánětlivé reakce (pulz > 90/min, TT > 37,8 °C, Hb < 106 g/l, ESR > 30 mm/hod, CRP > 30 mg/l). Tento stav je spojen s vysokým rizikem vzniku život ohrožujících komplikací, jak jsou toxické megakolon, perforace a sepse s multiorgánovým selháním.
Diagnostika
Stanovení diagnózy UC je založeno na vyhodnocení kombinace klinických příznaků, endoskopického vyšetření a histologického vyšetření. Součástí diagnostiky je stanovení aktivity a tíže onemocnění a také určení jeho rozsahu.
Endoskopie
Kolonoskopie představuje zlatý standard diagnostiky IBD. Umožňuje stanovení diagnózy, provedení diferenciální diagnostiky i určení aktivity a rozsahu nemoci. Další uplatnění má při monitorování odpovědi na medikamentózní terapii, dispenzarizaci a vyhledávání komplikací, popřípadě v rámci sledování nemocných po chirurgických výkonech. Značným vývojem procházejí také endoterapeutické metody používané u pacientů s IBD.
Nálezem charakteristickým pro UC je kontinuální postižení sliznice, které začíná v anorektální junkci a zaujímá celou cirkumferenci střeva. Přechod v normální sliznici je většinou ostrý, zánětlivý obraz v rozsahu několika centimetrů střídá normální sliznice. Zánětlivé změny jsou uniformní, zpravidla více vyjádřené v distálních částech tračníku a směrem orálním se jejich intenzita snižuje. V individuálních případech (např. vlivem terapie nebo u pacientů s PSC) mohou být nejtěžší změny lokalizované až v pravém tračníku. U 75 % nemocných s ohraničeným tvarem UC (proktitida nebo levostranný typ) jsou přítomné také zánětlivé změny na dně céka v okolí ústí apendixu, označované jako periapendikulární infiltrát. Jeho výskyt je pro UC specifický. V případě dlouhotrvajícího onemocnění dochází i k tvorbě polypů (histologicky se jedná o zánětlivé polypy), někdy označovaných jako pseudopolypy.
Pro stanovení aktivity UC existuje mnoho skórovacích systémů. Nejvyužívanějším endoskopickým indexem aktivity UC je tzv. skóre Mayo, 4stupňová škála (0–3), kde vyšší hodnota znamená větší aktivitu nemoci (viz tab. 2 + obr. 3a–d). Významným parametrem v tomto indexu je křehkost (friabilita) sliznice, která diferencuje lehkou aktivitu (eMayo 1) od středně těžké aktivity (eMayo 2).
Tab. 2 Endoskopická klasifikace UC – skóre Mayo
Skóre Mayo Aktivita Nález 0 žádná normální nález, bez známek aktivity nemoci 1 mírná erytém, edém sliznice, smazaná cévní kresba 2 středně těžká výrazný erytém, vymizení cévní kresby, křehká sliznice – kontaktně krvácející, drobné eroze 3 těžká spontánní krvácení, ulcerace Obr. 7a–d Obrazy odpovídající jednotlivým hodnotám skóre Mayo
Mayo 0
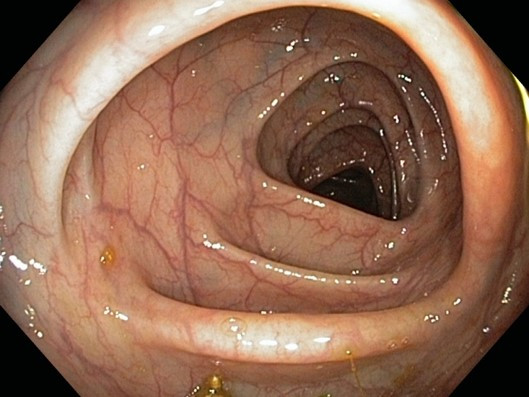
Mayo 1
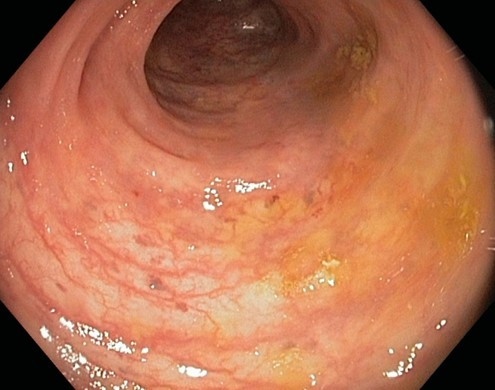
Mayo 2
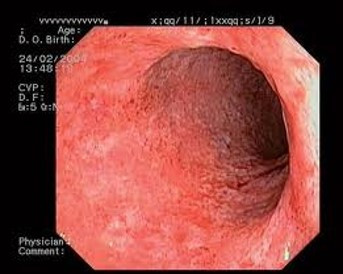
Mayo 3
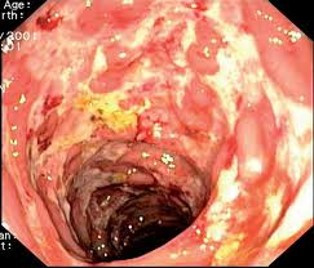
Zobrazovací metody
V poslední době se do popředí v klinické praxi dostává také ultrazvukové vyšetření tračníku. Uplatnění má zejména při hodnocení aktivity a extenze zánětu a monitorování odpovědi na léčbu. Určitou nevýhodou transabdominálního UZ je obtížná zobrazitelnost rekta, což limituje jeho použití u pacientů s proktitidou.
Další zobrazovací metody, jako prostý rtg snímek břicha či CT, jsou důležité především v diagnostice komplikací, zejména toxického megakolon. MRI se využívá hlavně při podezření na PSC.
Histologie (histopatologie)
Zánětlivé změny jsou zpravidla omezeny na sliznici tlustého střeva. Ve velmi těžkých stavech mohou být postiženy i hlubší vrstvy. Typickým histologickým nálezem je narušená architektonika kryt, difuzní zánětlivý infiltrát sliznice s bazální plazmocytózou, mohou se objevovat kryptitida, kryptové abscesy a redukce až zánik pohárkových buněk.
Laboratorní vyšetření
V období vysoké aktivity nemoci může být v krevním obrazu trias: anémie, leukocytóza a trombocytóza. Mikrocytová sideropenická anémie z chronických ztrát je při těžkém průběhu nemoci pravidlem. Mohou být patrné známky systémového zánětu (zvýšené hodnoty CRP či sedimentace erytrocytů).
Zdaleka nejcitlivějším a nejpřínosnějším laboratorním vyšetřením u UC a IBD obecně je stanovení fekálního kalprotektinu. Jedná se o protein uvolňovaný z cytosolu neutrofilních leukocytů po jejich migraci ze sliznice do lumen střeva a jejich následném rozpadu. Čím vyšší je koncentrace fekálního kalprotektinu, tím vyšší je infiltrace sliznice neutrofilními leukocyty a tím vyšší je aktivita nemoci. Tento marker je vhodný pro stanovení aktivity nemoci, monitorování odpovědi na léčbu nebo v predikci případného blížícího se relapsu.
Sérologická diagnostika může být nápomocná při stanovení diagnózy UC, nicméně vzhledem k její omezené senzitivitě jde pouze o pomocné vyšetření. Jedná s o stanovení protilátek proti cytoplazmatickým granulím neutrofilních leukocytů (pANCA), jejichž prevalence u UC dosahuje 40–80 %, zatímco u CN jsou detekovány u ˂ 10 % pacientů.
Střevní komplikace UC
Toxické megakolon
Závažnou komplikací akutní těžké kolitidy je vznik toxického megakolon. Jedná se o paralytický ileus tlustého střeva, který vede k dilataci tlustého střeva (především transverza) na > 6 cm. Toxické megakolon je spojeno s vysokým rizikem perforace tlustého střeva a vznikem difuzní sterkorální peritonitidy. Mortalita se v takových případech pohybuje až kolem 50 %.
Krvácení a perforace
Vzácnou komplikací může být masivní krvácení způsobené narušením stěny větší cévy vředovitým defektem/zánětem. Ke krvácení a perforaci střeva může dojít také iatrogenně při neopatrném endoskopickém vyšetření tračníku ve fázi těžké aktivity UC, kdy je střevní stěna velmi křehká. V takovém případě je jediným řešením neodkladný chirurgický výkon.
Stenóza střeva
Stenóza střeva, na rozdíl od CN, nepatří do běžného klinického obrazu UC. Nicméně dlouhotrvající chronické onemocnění může být strikturami komplikováno. Nález stenózy by však měl být vždy podezřelý z možnosti vzniku komplikace v podobě kolorektálního karcinomu a následně dovyšetřen.
Kolorektální karcinom
Pacienti s UC (kromě pacientů s proktitidou) mají asi 2× vyšší riziko vzniku KRK oproti běžné populaci. Míra rizika neoplazie stoupá s rozsahem postižení tlustého střeva (E2 → E3), délkou trvání nemoci, jejím chováním/aktivitou v průběhu let (přítomnost zánětlivých polypů a/nebo přetrvávající histologická aktivita) nebo při souběžném výskytu PSC, případně výskytu KRK u příbuzných 1. stupně.
Všichni nemocní s levostrannou či extenzivní kolitidou by měli být po 8 letech trvání obtíží (nikoliv od stanovení diagnózy, k němuž mnohdy dochází se zpožděním) zařazeni do dispenzárního kolonoskopického programu. Pacienti s izolovanou proktitidou do dispenzárního programu nespadají. U nemocných s vysokým rizikem by měla být dispenzární koloskopie prováděna 1× ročně, pacienti se středním rizikem by měli výkon podstoupit 1× za 2–3 roky a u jedinců, kteří nemají jiný rizikový faktor vyjma trvání nemoci a jsou dlouhodobě v remisi, je doporučeno provádět koloskopii 1× za 5 let (viz tab. 3).
Tab. 3 Intervaly dispenzární koloskopie (14)
Riziko KRK Zahájení po 8 letech od trvání příznaků, při dg. PSC ihned Interval Vysoké - stenóza nebo dysplazie v posledních 5 letech
- PSC (včetně stavu po Tx jater)
- extenzivní UC s vysoce aktivním zánětem
- příbuzný 1. stupně s KRK do 50 let věku
1× ročně Střední - extenzivní UC s mírným až středně aktivním zánětem
- pozánětlivé polypy (pseudopolypy)
- příbuzný 1. stupně s KRK nad 50 let věku
1× za 2–3 roky Nízké - UC postihující < 50 % povrchu
- ileální pouch
1× za 5 let Velmi nízké - izolovaná proktitida
- Pozn.: Vyšetření by mělo být prováděno ve fáze remise, s kvalitní přípravou a použitím chromoendoskopie + cílené biopsie (s alternativou kvadrantové biopsie každých 10 cm v bílém světle).
Smyslem dispenzární kolonoskopie je záchyt neoplazie v časné fázi, a tím zlepšení prognózy pacienta. V současné době se doporučuje provádět chromoendoskopii (použití indigokarmínu nebo methylenové modře) s cílenou biopsií suspektních lézí – tento postup zvyšuje míru detekce dysplazie. Alternativou je provádění náhodných kvadrantových biopsií (4 biopsie každých 10 cm) a cílené biopsie jakékoli viditelné léze, pokud je použita endoskopie v bílém světle. Je-li k dispozici, měla by být použita endoskopie ve vysokém rozlišení (HD). Současná data ukazují, že virtuální chromoendoskopie (např. NBI, FICE, i-scan) je srovnatelně účinná ve vyhledávání lézí jako klasická chromoendoskopie s barvením sliznice. Dispenzární kolonoskopie by se měly provádět ideálně v období remise onemocnění.
Dysplastická ložiska dělíme podle závažnosti dysplastických změn na lehká a těžká, podle viditelnosti na endoskopicky viditelná a neviditelná. V případě viditelné léze, kdy nejsou přítomná další ložiska, je indikovaná endoskopická terapie: polypektomie (EPE), slizniční resekce (EMR), popř. submukózní disekce (ESD). V případech, kdy není možné zjištěné ložisko endoskopicky odstranit nebo jsou-li přítomné další satelitní či vzdálená ložiska dysplazie, je indikovaná kolektomie.Endoskopie při ASUC
Endoskopické vyšetření může být přínosné i u pacientů s ASUC. Těžký nález s přítomností hlubokých vředů může být prediktorem nepříznivého průběhu, rizika další komplikace a podporuje provedení kolektomie. Zároveň může vyšetření posloužit k vyloučení nasedající infekční komplikace, např. cytomegalovirové infekce. U nemocných s prokázanou UC je dostačující sigmoideoskopie bez přípravy. Nutné je vyhnout se větší insuflaci střeva a použít oxid uhličitý. Výkon by měl provádět zkušený endoskopista, a to z důvodu vysokého rizika perforace a indukce toxického megakolon. Endoskopická léčba (desuflace) toxického megakolon je v současnosti kontraindikovaná.
Farmakoterapie
Medikamentózní terapii lze rozdělit na indukční a udržovací. Indukční léčba se podává při aktivním onemocnění, udržovací při klidovém stadiu, jedná se tedy o jakousi „profylaxi“ relapsu. Některé preparáty je vhodné používat jen pro indukční léčbu, jiné jsou vhodné pouze pro léčbu udržovací a další lze užít v obou indikacích. Forma léku, dávkování a jednotlivé kombinace se řídí rozsahem, tíží postižení a přítomností komplikací (viz tab. 4).
Tab. 4 Farmakoterapie UC
Léčivo/léková skupina Indukční léčba Udržovací léčba aminosalicyláty kortikosteroidy thiopuriny protilátky anti-TNF-α vedolizumab ustekinumab tofacitinib Aminosalicyláty
Mezi aminosalicyláty zahrnujeme léky obsahující kyselinu 5-aminosalicylovou (5-ASA), a to buď samostatně, nebo ve vazbě na nosič. Patří sem sulfasalazin (Salazopyrin, Sulfasalazin) a zástupci mesalazinu (Asacol, Pentasa, Salofalk).
Aminosalcyláty jsou základem konzervativní terapie UC s mírnou až středně vysokou aktivitou. Předpokládá se jejich přímý účinek na sliznici střeva, proto účinnost závisí na koncentraci léčiva nikoli v krvi, ale ve sliznici střeva. Jejich účinek je protizánětlivý, nikoliv imunosupresivní. Mají výborný bezpečnostní profil. Nejzávažnějším nežádoucím účinkem 5-ASA je intersticiální nefritida (idiosynkratická reakce), která se vyskytuje u < 0,05 % pacientů.
Lze je užívat systémově a též lokálně. Pro lokální podávání má léčivo formu čípků nebo klyzmat. Dostupnost je omezena zvolenou formou. V případě čípků je dosažitelnost maximálně do 10–15 cm od análního okraje, u klyzmat až do oblasti descendentu/lienální flexury. Rozsah postižení střeva je rozhodující při volbě lokální nebo systémové léčby. V současné době se i pro extenzivní tvar UC ve fázi mírné až střední aktivity volí kombinovaná terapie.
Obvyklá délka indukční léčby je 6–8 týdnů. Maximální denní dávka perorálně podávaného léku činí 4,8 g. Preferováno je podávání 1 denní dávky, která má prokazatelně vyšší efektivitu v porovnání se stejnou dávkou rozdělenou do několika dílčích, zároveň se tím docílí větší adherence pacientů k léčbě. Doporučená denní dávka lokální terapie v podobě čípků pro proktitidu činí 1 g, a to buď jednorázově, nebo ve dvou dílčích.
V udržovací terapii by měla být minimální dávka mesalazinu 2 g denně, u nemocných s velmi častými relapsy vyšší než 2,4 g, naopak u nemocných s málo frekventními relapsy je dostačující 1 g denně. V případě lokální udržovací terapie je doporučená dávka 3 g týdně.
Podávání sulfasalazinu má v současné době jen velmi omezený význam, uplatňuje se u pacientů s enteropatickou artritidou II. typu.
Glukokortikoidy
Glukokortikoidy (GK) tvoří základ léčby středně až vysoce aktivní UC. Uplatňují se v indukční fázi léčby. Zavedení GK jako terapeutické možnosti u nemocných s UC a CN v polovině 50. let 20. století významně snížilo mortalitu na tato onemocnění. Můžeme je dělit na kortikoidy systémové (s perorální či intravenózní cestou podávání), topické (budesonid) a lokální (čípky, pěny).
V terapii systémově působícími GK se využívají prednison a methylprednisolon pro perorální léčbu a methylprednisolon pro intravenózní aplikaci. Úvodní dávka při ambulantní perorální léčbě činí 0,5–1 mg/kg a neměla by přesáhnout 60 mg denně. Obvykle se podává po dobu nejméně 1 týdne a poté je doporučeno postupné snižování. Neexistuje univerzálně doporučený postup, jak dávku snižovat, celková délka léčby by však neměla být delší než 12 týdnů. Při akutní těžké atace UC se doporučuje podat methylprednisolon intravenózně v dávce 60 mg za 24 hod. Vyšší dávky nejsou efektivnější, nižší jsou méně účinné. V případě, že dojde ke zlepšení stavu, má terapie pokračovat maximálně po dobu 7–10 dnů s následným převedením na perorální podávání, delší intravenózní podávání pacientovi nepřináší další benefit.
Hlavní výhodou topických kortikosteroidů (budesonid) je vysoký tzv. first pass effect. Po vstřebání z trávicí trubice se dostávají do portálního oběhu a při prvním průchodu játry jsou téměř zcela (≥ 90 %) odbourány. Důsledkem je minimální biologická systémová dostupnost, čímž je zároveň minimalizován výskyt nežádoucích účinků. K terapii UC je indikován přípravek MMX budesonid (Cortiment) s nosičovým systémem multimatrix, který umožňuje uvolnění účinné látky až v tlustém střevě. Dávkování je 9 mg (1 tbl.) denně po dobu 8 týdnů, poté se postupně vysazuje.
Topické KS mají nižší účinnost než systémové kortikoidy, využití mají zejména v indukci remise u pacientů s mírně až středně aktivní UC, kteří nereagují na 5-ASA nebo ji netolerují. K lokálnímu podávání se může využívat budesonid (2 mg), např. ve formě rektální pěny. Rektální pěna je mnohem lépe tolerována než klyzma, zvláště u nemocných s dlouhotrvajícím zánětem postihujícím rektum nebo levostrannou formou, kteří mají větší dráždivost a časté tenesmy.
Velmi dobrý a promptní protizánětlivý účinek je u pacientů, kteří dosud kortikoidy neužívali („kortikoid-naivních“) – u nich přesahuje 90 % a klesá s dalším opakováním terapie. Část pacientů na léčbu neodpoví, jsou tzv. kortikorezistentní. Až u třetiny pacientů s primárně dobrou odpovědí se vyvine kortikodependence, což znamená neschopnost snížit dávku KS pod ekvivalent 10 mg prednisolonu v průběhu 3 měsíců od zahájení léčby z důvodu relapsu nemoci nebo relaps nemoci do 3 měsíců od vysazení KS. V těchto případech je nutné nemocné převést na vyšší terapeutickou linii.
Zásadním limitem dlouhodobé kortikoterapie jsou četné a závažné nežádoucí účinky (NÚ), jejich riziko narůstá s délkou podávání KS. Mezi NÚ se mohou objevit např. strie, cushingoidní vzhled, deprese, snížení rezistence vůči infekcím, manifestace/dekompenzace diabetu mellitu, dyslipidémie, glaukom, osteoporóza. Systémové kortikoidy v dávce > 20 mg denně podávané minimálně 4–6 týdnů významně zvyšují krátkodobou pooperační morbiditu a mortalitu.
Imunosupresiva
Imunosupresiva by měla být využívána zejména jako dlouhodobá udržovací terapie. Výjimkou je pouze cyklosporin A, který se podává intravenózně jako záchranná terapie u ASUC. Relativně novou indikací imunosupresiv je přídatná léčba k protilátkám anti-TNF, podávaná za účelem snížení imunogenicity biologik. Mezi imunosupresiva používaná u UC řadíme thiopuriny azathioprin (AZA) a 6-merkaptopurin (6-MP), dále cyklosporin A (CSA) a takrolimus.
Thiopuriny
Thiopuriny jsou proléčiva, jež v několika krocích konvertují na aktivní metabolit 6-thioguaninový nukleotid, který interferuje se syntézou nukleových kyselin. Mají pomalý nástup účinku (3–6 měsíců). Využívají se u pacientů s mírnou až středně aktivní UC, u kterých selhala udržovací léčba 5-ASA, nebo u kortikodependentních jedinců.
Obvyklá denní dávka thiopurinů činí 2–2,5 mg/kg u AZA a 0,5–1,5 mg/kg u 6-MP. Kombinace redukovaných dávek AZA nebo 6-MP s alopurinolem umožňuje zefektivnit léčbu a minimalizovat výskyt některých jejích nežádoucích účinků (hepatopatie, intolerance). Celkově se NÚ vyskytují u 20–30 % pacientů. Patří mezi ně např. hematologické komplikace (leukopenie a lymfopenie, výjimečně až aplazie kostní dřeně), akutní pankreatitida, infekční komplikace, hlavně virové infekce (HSV, CMV, EBV, VZV). S terapií je spojeno i zvýšené riziko vzniku lymfomů (4–5násobné), které trvá pouze po dobu podávání léčby a stoupá s věkem, a také zvýšené riziko nemelanomového nádoru kůže.
Cyklosporin A
Podávání CSA je omezeno pouze na záchrannou terapii u nemocných s akutní těžkou UC jako tzv. bridging terapie, než začnou působit thiopuriny nebo biologická léčba. Podává se intravenózně v dávce 2 mg/kg po dobu 7–10 dnů, v případě pozitivní odpovědi je poté pacient převáděn na perorální léčbu v dávce 5–7 mg/kg, ve které se pokračuje maximálně 3 měsíce. Souběžně s perorálním užíváním CSA se nasazuje AZA ve standardní dávce. Po 3 měsících kombinované léčby se podávání CSA ukončuje a pokračuje pouze léčba azathioprinem. Novým přístupem se zdá být podávání vedolizumabu místo AZA. CSA je látka s potenciálně závažnými NÚ, proto je nutné jeho podávání pečlivě klinicky a laboratorně monitorovat.
Takrolimus
Tento kalcineurinový inhibitor má mechanismus účinku stejný jako CSA. Běžně se používá u pacientů po orgánových transplantacích. V praxi se u nemocných s UC může využít při přítomnosti refrakterní proktitidy, a to ve formě čípků nebo nálevů v dávce 1 mg denně.
Cílená léčba
Biologická léčba (BL) IBD zahrnuje monoklonální protilátky zaměřené proti specifickému antigenu. Její zavedení u pacientů s IBD znamenalo velký pokrok v léčbě těchto onemocnění. V současné době máme pro léčbu UC k dispozici 3 skupiny přípravků s různým mechanismem účinku: protilátky anti-TNF-α, antiintegrinovou protilátku (vedolizumab) a protilátku proti podjednotce p40 interleukinů 12 a 23 (ustekinumab). U všech preparátů byla prokázána účinnost v indukční i udržovací léčbě UC a z medicínského hlediska je lze podat již v 1. linii.
Obecnou indikací k BL u pacientů s UC je střední a vysoká aktivita nemoci při neúčinnosti konvenční terapie, kortikodependentní průběh nemoci a výskyt některých mimostřevních projevů. Specifickou indikací je akutní těžká ataka UC, kdy je BL (konkrétně infliximab) indikovaná po selhání parenterální terapie systémovými kortikosteroidy jako tzv. záchranná terapie před případnou kolektomií.
Mezi kontraindikace podání anti-TNF terapie patří předchozí těžká alergická reakce, aktivní infekční onemocnění, přítomnost nedrénovaného abscesu, demyelinizační onemocnění a pokročilé srdeční selhání (NYHA III–IV). Kontraindikacemi pro podání vedolizumabu a ustekinumabu jsou alergická reakce a aktivní těžká infekce.
Podávání všech biologických přípravků se zahajuje tzv. indukční léčbou, kdy se užívají vyšší dávky nebo je léčba aplikovaná v kratších intervalech. Pokud pacient na indukční léčbu odpoví a toleruje ji, přechází do dlouhodobé udržovací fáze.
Přehled jednotlivých cílených přípravků, způsob aplikace a jejich dávkování uvádí tab. 5.
Tab. 5 Přehled, způsob aplikace a dávkování cílené terapie
Přípravek Indukční fáze Udržovací fáze anti-TNF-α
infliximab (i.v.)
adalimumab (s.c.)
golimumab (s.c.)5 mg/kg v 0., 2. a 6. týdnu
160 mg v 0. týdnu, 80 mg v 2. týdnu
200 mg v 0. týdnu, 100 mg v 2. týdnu5 mg/kg každých 8 týdnů
40 mg každé 2 týdny
50 mg každé 4 týdny (hmotnost ≤ 80 kg)
100 mg každé 4 týdny (hmotnost > 80 kg)vedolizumab (i.v.) 300 mg v 0., 2., 6. týdnu 300 mg každých 8 týdnů ustekinumab 260 mg i.v. (hmotnost < 55 kg)
390 mg i.v. (hmotnost 55–85 kg)
520 mg i.v. (hmotnost > 85 kg)90 mg s.c. každých 12, resp. 8 týdnů tofacitinib (p.o.) 10 mg 2× denně po dobu 8 týdnů 5 mg 2× denně Pozn.: V případě potřeby intenzifikace léčby lze u anti-TNF-α navýšit jednotlivé dávky nebo zkrátit interval podávání, v případě vedolizumabu a ustekinumabu se intenzifikuje zkrácením intervalu (jednotlivé dávky se nenavyšují), u tofacitinibu lze pokračovat v podávání zvýšené dávky 2× 10 mg denně.
Primární účinnost (odpověď na indukční léčbu) se u naivních pacientů, kteří nikdy nedostávali biologickou léčbu, pohybuje mezi 70 a 90 %. Nicméně u významné části primárních respondérů dochází v průběhu léčby ke ztrátě odpovědi (tzv. sekundární non-respondéři) – 15 % nemocných v každém roce léčby.
Dalším medicínským problémem, který se týká převážně protilátek anti-TNF-α, je nutnost ukončit léčbu z důvodu nežádoucích účinků (infekční komplikace, kožní nežádoucí projevy, alergické reakce), které se mohou projevit za různě dlouhou dobu od jejího zahájení.
Protilátky anti-TNF-α
Tumor nekrotizující faktor alfa (TNF-α) je důležitý prozánětlivý mediátor vrozené a získané imunity a hraje klíčovou roli v patogenezi nejen IBD, ale i jiných autoimunitních a neautoimunitních onemocnění (revmatoidní artritida, psoriáza, ankylozující spondylitida). Pleomorfní protizánětlivý efekt monoklonálních protilátek anti-TNF-α je zprostředkováván vazbou na komplex TNF-α na membránách imunokompetentních buněk.
Anti-TNF-α přípravky, a především infliximab, se ve srovnání s dalšími biologickými léčivy vyznačují promptním nástupem účinku. Hodí se tak pro pacienty s vysokou aktivitou nemoci a potřebou rychlého dosažení remise. Specifickou indikaci tvoří pacienti s akutní těžkou UC, u kterých je lékem 1. volby infliximab v intenzifikovaném režimu. Mezi přednosti anti-TNF-α preparátů patří také jejich účinnost v léčbě mimostřevních projevů, které nejsou vázané na aktivitu střevního zánětu, jako pyoderma gangrenosum, uveitida nebo sakroileitida.
Určitou nevýhodu anti-TNF-α léčiv, a zvláště infliximabu, představuje jejich klinicky významná imunogenicita s tvorbou protilékových protilátek (infliximab 0–83 %, adalimumab 0–54 %, golimumab 0–19 %), jež mohou vést ke ztrátě terapeutického efektu nebo indukovat vznik některých NÚ. Ke snížení imunogenicity je proto doporučeno (převážně u infliximabu) podávání v kombinaci s imunosupresivy.
Další nevýhodu představuje systémový imunosupresivní efekt a s ním spojené zvýšené riziko závažných infekčních komplikací. Toto riziko dále narůstá při použití kombinace BL s imunosupresivy nebo KS. Rizikovou skupinu tvoří hlavně starší pacienti, u kterých je výskyt závažných a oportunních infekcí 2–3násobný oproti mladším jedincům.
Neinfekční, imunopatologicky podmíněné kožní NÚ se vyskytují až u 20 % pacientů užívajících anti-TNF-α léčiv a mohou se objevit za různě dlouhou dobu od zahájení terapie. Kožní projevy mohou mít různý charakter, a to i u téhož pacienta. Často jde o tzv. ekzematiformní nebo psoriatiformní léze. Dále lze pozorovat kožní projevy vaskulitidy (leukocytoklastová vaskulitida), palmoplantární pustulózu nebo výjimečně i vznik generalizované psoriázy (1 %). Většina kožních NÚ má naštěstí mírný průběh, dobře reaguje na dermatologickou léčbu a spíše zřídka jsou důvodem k nutnosti ukončit podávání biologik.
Antiintegriny
Tato skupina biologických přípravků zahrnuje zatím jednoho zástupce schváleného pro léčbu UC – vedolizumab. Jedná se o humanizovanou monoklonální protilátku IgG1 proti leukocytovému integrinovému receptoru α4β7. Vazbou vedolizumabu na tento receptor dochází k blokádě přestupu aktivovaných lymfocytů z oběhu do sliznice gastrointestinálního traktu.
Velkou výhodou vedolizumabu je jeho převážně selektivní působení v trávicím traktu a s ním související významně lepší bezpečnostní profil. Z hlediska bezpečnosti představuje optimální léčivo pro pacienty se zvýšeným rizikem infekčních komplikací (vyšší věk, závažné komorbidity, prodělané infekční komplikace) nebo malignitou v osobní anamnéze. Další výhodou vedolizumabu oproti protilátkám anti-TNF-α je jeho významně nižší imunogenicita (protilékové protilátky u ˂ 5 % léčených pacientů) a absence nutnosti kombinované imunosupresivní terapie.
Antiinterleukiny
Ustekinumab je kompletně humánní monoklonální protilátka IgG1, která blokuje podjednotku p40 interleukinů 12 a 23 (IL-12/IL-23). Tyto IL představují důležité signální molekuly, jež mají významnou úlohu v patogenezi řady autoimunitních onemocnění, včetně IBD. Blokádou prozánětlivé signální dráhy IL-12/IL-23 dochází ke snížení aktivity TH1 lymfocytů a potlačení tvorby dalších prozánětlivých cytokinů.
I když má ustekinumab, podobně jako anti-TNF-α terapie, systémový efekt, doposud publikované údaje u pacientů s IBD nebo psoriázou poukazují na jeho příznivý bezpečností profil, včetně minimálního rizika infekcí. Přínosem tohoto léku je i nízká imunogenicita (< 5 % léčených pacientů), efektivita v monoterapii a snížení nutnosti kombinované terapie s kortikosteroidy.
Malé molekuly
Malé molekuly (SMD – small molecule drugs) mají v porovnání s BL výhodu v perorálním podání, absenci imunogenicity, což zajišťuje dlouhodobou účinnost a perzistenci léčiva, a také jednodušší a méně finančně nákladný výrobní proces. V současné době je zavedena do klinické praxe k léčbě UC první molekula – tofacitinib.
Tofacitinib je perorální neselektivní inhibitor Janusových kináz (JAK). Inhibuje především aktivitu JAK1 a JAK3. Doporučené dávkování je v indukční fázi 2× 10 mg denně a v udržovací fázi 2× 5 mg denně.
Nejčastějšími NÚ jsou infekční komplikace, specificky je zvýšené riziko pásového oparu, dále dyslipidémie (elevace cholesterolu, LDL a HDL), která však není spojená se zvýšením kardiovaskulárního rizika. Nejasnosti zatím panují ohledně možného vyššího rizika tromboembolických příhod u pacientů s rizikovými faktory pro tyto komplikace při léčbě vyššími dávkami, tedy 2× 10 mg denně.
Chirurgická léčba
Léčba UC je převážně konzervativní, nicméně asi 15–20 % nemocných si v průběhu nemoci vyžádá chirurgickou terapii. Indikací k chirurgickému zákroku jsou kromě toxického megakolon také opakované těžké ataky nemoci, jež nereagují na farmakologickou terapii, nebo nález dysplazie či karcinomu. U UC se provádí restorativní proktokolektomie s ileopouchanální anastomózou (IPAA) nebo proktokolektomie s terminální ileostomií jako definitivním řešením.
Proktokolektomie s terminální ileostomií jako definitivním řešením je vhodná u nemocných s insuficientní funkcí análního svěrače, morbidně obézních, u starších osob nebo pacientů ve špatném klinickém stavu.
Proktokolektomie s vytvořením IPAA umožňuje dlouhodobou rekonstrukci zažívacího traktu bez trvalé ileostomie. U více než 90 % takto operovaných pacientů s UC je pouch dobře funkční dlouhou dobu, přesahující i 20 let. Tento výkon je nejčastěji prováděn ve dvou dobách. V první době se provede proktokolektomie s přerušením rekta 1–2 cm od linea dentata, z kličky terminálního ilea se vytvoří 16–18 cm dlouhý vak (pouch), nejčastěji tvaru „J“. Výkon je zakončen axiální ileostomií. S odstupem 3–6 měsíců, po provedení kontrolní endoskopie (pouchoskopie) a pouchografie s potvrzením zhojení, se ileostomie zruší a obnoví se střevní kontinuita.
Pokrokem v chirurgické terapii je možnost provedení těchto výkonů laparoskopicky. V důsledku minimální traumatizace v malé pánvi je např. daleko větší pravděpodobnost přirozené fertility u žen. Otevřené výkony s přechodnou ileostomií navíc mohou v následujících letech vést k adhezivnímu ileu (až u cca 25 % nemocných). Intestinální obstrukce se u nemocných, kteří podstoupili laparoskopický výkon, téměř nevyskytují. Laparoskopie umožňuje šetřit břišní stěnu a má také příznivější kosmetický efekt.
MUDr. Martin Vašátko
Klinické a výzkumné centrum pro střevní záněty ISCARE a 1. LF UK v PrazeLiteratura:
- Lukáš M a kol. Idiopatické střevní záněty. Nové trendy a mezioborové souvislosti. Grada, Praha, 2020.
- Piovani D, Danese S, Peyrin-Biroulet L, Bonovas S. Inflammatory bowel disease: estimates from the global burden of disease 2017 study. Aliment Pharmacol Ther 2020 Jan; 51(2): 261–270.
- Lukáš M. Idiopatické střevní záněty. Nejistoty, současné znalosti a klinický přístup. Galén, Praha, 1998.
- Bureš J, Horáček J, Malý J a kol. Vnitřní lékařství. 2., přepracované vydání. Galén, Praha, 2014.
- Češka R et al. Interna. 3., aktualizované vydání. Triton, Praha, 2020.
- Magro F, Gionchetti P, Eliakim R et al. European Crohn’s and Colitis Organisation [ECCO]. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: Definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. J Crohns Colitis 2017; 11(6): 649–670.
- Lukáš M a kol. Pokroky v diagnostice a léčbě idiopatických střevních zánětů. Galén, Praha, 2019.
- Maconi G, Nylund K, Ripolles T et al. EFSUMB recommendations and clinical guidelines for intestinal ultrasound (GIUS) in inflammatory bowel diseases. Ultraschall Med 2018; 39(3): 304–317.
- Maconi G, Ardizzone S, Parente F, Bianchi Porro G. Ultrasonography in the evaluation of extension, activity, and follow-up of ulcerative colitis. Scand J Gastroenterol 1999; 34(11): 1103–1107.
- Civitelli F, Di Nardo G, Oliva S et al. Ultrasonography of the colon in pediatric ulcerative colitis: a prospective, blind, comparative study with colonoscopy. J Pediatr 2014; 165(1): 78–84.e2.
- Allocca M, Fiorino G, Bonovas S et al. Accuracy of humanitas ultrasound criteria in assessing disease activity and severity in ulcerative colitis: a prospective study. J Crohns Colitis 2018; 12(12): 1385–1391.
- Parente F, Molteni M, Marino B et al. Bowel ultrasound and mucosal healing in ulcerative colitis. Dig Dis 2009; 27(3): 285–290.
- Parente F, Molteni M, Marino B et al. Are colonoscopy and bowel ultrasound useful for assessing response to short-term therapy and predicting disease outcome of moderate-to-severe forms of ulcerative colitis? A prospective study. Am J Gastroenterol 2010; 105(5): 1150–1157.
- Annese V, Daperno M, Rutter MD et al. European evidence-based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7(12): 982–1018.
- Falt P a kol. Koloskopie. Grada, Praha, 2015.
- Fefferman DS, Farrell RJ. Endoscopy in inflammatory bowel disease: indications, surveillance, and use in clinical practice. Clin Gastroenterol Hepatol 2005; 3(1): 11–24.
- Hurst AF. Ulcerative colitis. Lancet 1923; 1 : 1007.
- Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001 Apr; 48(4): 526–35.
- Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer 2001; 91 : 854–862.
- Rutter MD, Saunders BP, Wilkinson KH et al. Thirty-year analysis of a colonoscopic surveillance program for neoplasia in ulcerative colitis. Gastroenterology 2006; 130(4): 1030–1038.
- Bajer L, Kamenář D, Sticová E a kol. Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD. Gastroenterologie a hepatologie 2014; 64(1): 24–35.
- Lukáš M. Idiopatické střevní záněty a kolorektální karcinom. Nové souvislosti a další perspektivy. Česká a slovenská gastroenterologie a hepatologie 2006; 60(3): 113–118.
- Azad Khan AK, Paris J, Truelove S. An experiment to determine the active therapeutic moiety of sulphasalazine. Lancet 1977; 2(8044): 892–895.
- Bortlík M. Vývoj léčby idiopatických střevních zánětů v posledních 20 letech. Gastroenterologie a hepatologie 2015; 69(4): 341–350.
- Harbord M, Eliakim R, Bettenworth D et al.; European Crohn’s and Colitis Organisation (ECCO). Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: Current management. J Crohns Colitis 2017; 11 (7): 769–784.
- Prokopová L, Ďuricová D, Bortlík M a kol. Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroenterologie a hepatologie 2012; 66 (5): 391–400.
- Truelove SC, Witts LJ. Cortisone in ulcerative colitis. Final report on a therapeutic trial. Br Med J 1955; 2(4947): 1041–1048.
- Hrdlička L, Bortlík M, Douda T a kol. Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v realné klinické praxi. Gastroenterologie a hepatologie 2016; 70(6): 509–513.
- Ardizzone S, Maconi G, Russo A et al. Randomised controlled trial of azathioprine and 5-aminosalicylic acid for treatment of steroid dependent ulcerative colitis. Gut 2006; 55(1): 47–53.
- Panaccione R, Ghosh S, Middleton S et al. Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology 2014; 146 : 392–400.
- Roblin X, Williet N, Peyrin-Biroulet L et al. Thiopurine metabolism in the era of combotherapy. Inflamm Bowel Dis 2016; 22(6): 1496–1501.
- Abbas AM, Almukhtar RM, Loftus EV et al. Risk of melanoma and non-melanoma skin cancer in ulcerative colitis patients treated with thiopurines: a nationwide retrospective cohort. Am J Gastroenterol 2014; 109(11): 1781–1793.
- Annese V, Beaugerie L, Egan L et al. European evidence-based consensus: inflammatory bowel disease and malignancies. J Crohns Colitis 2015; 9(11): 945–965.
- Lawrance IC, Copeland TS. Rectal tacrolimus in the treatment of resistant ulcerative proctitis. Aliment Pharmacol Ther 2008; 28(10): 1214–1220.
- Bortlík M, Ďuricová D, Kohout P a kol. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroenterologie a hepatologie 2019; 73(1): 11–24.
- Kolar M, Duricova D, Bortlik M et al. Infliximab biosimilar (Remsima) in therapy of inflammatory bowel diseases patients: experience from one tertiary inflammatory bowel diseases centre. Dig Dis 2017; 35(1–2): 91–100.
- Lukáš M. Klinický význam monitorování farmakokinetiky biologických léčiv u nemocných s idiopatickými střevními záněty. In: Špičák J (ed.). Novinky v gastroenterologii a hepatologii. Grada, Praha, 2017 : 39–51.
- Lukáš M. Obecné principy biologické léčby u IBD. In: Pavelka K a kol. (eds.). Biologická léčba zánětlivých autoimunitních onemocnění. Grada, Praha, 2014 : 253–264.
- Lukáš M. Vedolizumab v léčbě ulcerózní kolitidy. Gastroenterologie a hepatologie 2015; 69(1): 29–32.
- Falt P. Léčba vedolizumabem u pacientů s idiopatickými střevními záněty v České republice. Gastroenterologie a hepatologie 2017; 71(1): 19–23.
- Engel T, Ungar B, Yung DE et al. Vedolizumab in IBD-lessons from real-world experience; a systematic review and pooled analysis. J Crohns Colitis 2018; 12(2): 245–257.
- Konsensus odborníku v terapeutické oblasti IBD. Dostupné na: www.ibd-skupina.cz
- Lukáš M. Ustekinumab – nové biologikum v terapii Crohnovy nemoci. Gastroenterologie a hepatologie 2017; 71(1): 36–39.
- Lukáš M. Ustekinumab – nová biologická léčba pro pacienty s Crohnovou chorobou. Gastroenterologie a hepatologie 2017; 71(2): 178–180.
- Olivera P, Danese S, Peyrin-Biroulet L. Next generation of small molecules in inflammatory bowel disease. Gut 2017; 66(2): 199–209.
- Sandborn WJ, Su C, Sands BE et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 376(18): 1723–1736.
- Rubin DT, Dubinsky MC, Lukas M et al. Long-term efficacy of tofacitinib in patients who received extended induction therapy: results of the OCTAVE open study for tofacitinib delayed responders. J Crohns Colitis 2019; 13(Suppl. 1): S051.
- Polívková S, Vojtilová L, Husa P, Beneš J. Doporučený postup fekální bakterioterapie pro léčbu rekurentní klostridiové kolitidy. Klinická mikrobiologie a infekční lékařství 2018; 24(2): 57–64.
- Gasbarrini A. The gut microbiota. The 4th organ of the digestive system. Verduci, Řím, 2013.
- Imdad A, Nicholson MR, Tanner-Smith EE et al. Fecal transplantation for treatment of inflammatory bowel disease. Cochrane Database Syst Rev 2018; 11(11): CD012774.
- Bennet JD, Brinkman M. Treatment of ulcerative colitis by implantation of normal colonic flora. Lancet 1989; 1(8630): 164.
- Ferrari L, Krane MK, Fichera A. Inflammatory bowel disease surgery in the biologic era. World J Gastrointest Surg 2016; 8(5): 363–370.
- Jarkovský J, Benešová K, Hejduk K a kol. Epidemiologie, hospitalizační léčba a migrace IBD pacientů za specializovanou péčí v České republice. Gastroenterologie a hepatologie 2017; 6 : 501–509.
- Beyer-Berjot L, Maggiori L, Birnbaum D et al. A total laparoscopic approach reduces the infertility rate after ileal pouch-anal anastomosis: a 2-center study. Ann Surg 2013; 258(2): 275–82.
- Magro F, Gionchetti P, Eliakim R et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: Definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. J Crohns Colitis 2017; 11(6): 649–670.
- Mertz A, Nguyen NA, Katsanos KH et al. Primary sclerosing cholangitis and inflammatory bowel disease comorbidity: an update of the evidence. Ann Gastroenterol 2019; 32(2): 124–133.
- Verdon C, Bessissow T, Lakatos PL. Management of acute severe colitis in the era of biologicals and small molecules. J Clin Med 2019; 8(12): 2169.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



