-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVysoké dávky statinů
Datum publikace: 13. 7. 2017
Kardiovaskulární onemocnění (KVO) jsou hlavní příčinou morbidity a mortality ve vyspělých zemích, a proto je jedním z cílů moderní medicíny prevence jejich vzniku. V rámci primární i sekundární prevence se u našich pacientů snažíme zabránit rozvoji KVO jednak pomocí úpravy životního stylu vhodnými režimovými opatřeními – nekuřáctvím, úpravou jídelníčku, pravidelnou fyzickou aktivitou a duševní hygienou – a jednak v případě potřeby indikovanou farmakoterapií. Prevence KVO je vedle léčby arteriální hypertenze a diabetu založena především na terapii dyslipidemie.
Dyslipidemie je charakterizována nevhodným poměrem lipoproteinů anebo jejich patologickými hladinami, což prokazatelně vede k postupnému rozvoji aterosklerózy a jejích komplikací. Existuje několik dělení dyslipidemií, avšak v klinické praxi se orientujeme především podle příčiny vzniku dyslipidemie, tedy rozdělení na primární či sekundární. Sekundární dyslipidemie jsou podmíněné jinou chorobou, přičemž velice často dochází s léčbou základního onemocnění k úpravě koncentrací lipidového spektra. Primární dyslipidemie, které tvoří přibližně 90 %, jsou dané geneticky a je nezbytné je včas a důsledně léčit. Primární dyslipidemie dále můžeme rozdělit na izolovanou hypercholesterolemii, smíšenou dyslipidemii a izolovanou hypertriglyceridemii – toto rozdělení je praktické především při volbě terapeutického postupu.
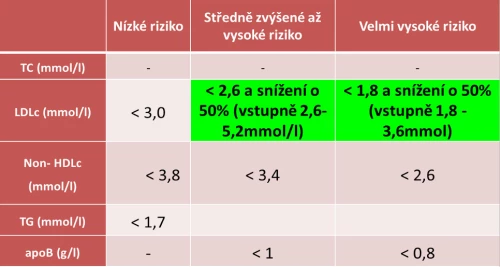
Léčbou dyslipidemie se snažíme snížit riziko klinické manifestace aterosklerózy i kardiovaskulární, potažmo celkové mortality. Cílem tedy není pouze optimalizace lipidogramu a při zvažování farmakoterapie je nezbytné důsledně zhodnotit veškeré rizikové faktory pacienta a jeho individuální kardiovaskulární riziko (viz tabulka č. 1). Podle výše rizika jsme poté schopni určit cílové hodnoty léčby a zvolit optimální dávkování, které samozřejmě následně titrujeme k požadovaným cílovým koncentracím.
Tabulka č. 1: Kategorie kardiovaskulárního rizika (1).

AAA – aneuryzma abdominální aorty; CKD – chronic kidney disease, chronické onemocnění ledvin; DM – diabetes mellitus; FH – familiární hypercholesterolemie; ICHS – ischemická choroba srdeční; ICHDK – ischemická choroba dolních končetin; KV – kardiovaskulární; KVO – kardiovaskulární onemocnění; MAU – mikroalbuminurie; RF – rizikový faktor aterosklerózy
Farmakologická léčba
V současné době máme k dispozici v zásadě tři třídy hypolipidemik. Jednoznačně nejvíce užívanými hypolipidemiky jsou statiny, inhibitory 3hydroxy-3methylglutaryl-koenzym A (HMG-CoA) reduktázy. Statiny působí v játrech v klíčovém kroku syntézy cholesterolu, kde inhibují činnost HMG-CoA reduktázy, čímž snižují produkci cholesterolu v hepatocytu. Důsledkem je zvýšení exprese LDL receptorů na jaterních buňkách, zvýšené vychytávání LDL cholesterolu (LDL-c), a tedy pokles hladiny LDL-c v krvi. Statiny mají vedle hypolipidemického účinku také tzv. pleiotropní účinek – působí protizánětlivě a antiagregačně, stabilizují aterosklerotické pláty, inhibují proliferaci buněk hladké svaloviny v cévní stěně a zlepšují funkci endotelových buněk. V současné době užívá v České republice statiny více než 900 tisíc pacientů.
Další terapeutickou možností je ezetimib, selektivní blokátor absorpce cholesterolu ve střevě prostřednictvím interakce s Niemann-Pick C1 like proteinem. Tento lék má aditivní efekt při přidání ke statinu a většinou jej indikujeme do kombinační terapie v případě nedostatečného efektu statinu, eventuálně při intoleranci statinů jako kombinační léčbu s nižší dávkou statinu. Vzácně je možné pacienty léčit pouze ezetimibem, nicméně tato léčba má omezený účinek – organismus reaguje na snížený přísun cholesterolu ze stravy vyšší produkcí játry. V klinické praxi se ovšem setkáváme s případy pacientů, kteří z jakéhokoli důvodu nemohou být léčeni statiny a monoterapie ezetimibem má u některých poměrně dobrý efekt.
Posledním lékem je fenofibrát, u nás nejpoužívanější lék ze skupiny fibrátů, agonistů jaderných receptorů PPAR. Tyto léky indikujeme především u pacientů s hypertriglyceridemií, efekt fenofibrátu je také v mírném vzestupu HDL cholesterolu (HDL-c) a posunu kvality lipoproteinů k méně aterogenním formám.
Cílové hodnoty LDL-c
Z hlediska hodnocení míry kardiovaskulárního rizika je zcela zásadní koncentrace LDL-c, jehož stoupající hladina je podle mnoha studií spojena s vyšší incidencí KVO. Z nespočtu epidemiologických i intervenčních studií je k dispozici řada důkazů o roli LDL-c v odhadu individuálního kardiovaskulárního rizika i monitoraci léčby (2–5). Studie IMPROVE-IT z roku 2015 opět potvrdila, že pokles hladiny LDL-c znamená také klesající KV riziko (6). Podrobněji se ovlivněním KV rizika spolu se změnou koncentrace LDL-c zabývala studie z roku 2012, jejíž autoři zjistili asociaci snížení koncentrace LDL-c o 1 mmol/l s redukcí rizika všech cévních příhod o 21 % (koronárních příhod o 24 % a CMP o 15 %), přičemž o 12 % klesá také riziko úmrtí na KVO (7). V roce 2014 byla provedena metaanalýza 8 studií, která srovnávala pacienty s hladinou LDL-c pod 1,3 mmol/l s referenční skupinou pacientů s neuspokojivě kontrolovaným LDL-c nad 4,5 mmol/l. Nemocní s velmi nízkými koncentracemi LDL-c vykazovali snížené relativní riziko makrovaskulárních příhod o 56 %, koronárních příhod o 53 % a cerebrovaskulárních příhod o 63 %, přičemž pokles rizika plynule pokračoval spolu s klesající hladinou LDL-c (viz obrázek č. 1; 8). Nejen zmíněné studie znovu prokázaly často zmiňovanou základní tezi managementu dyslipidemie: čím nižší LDL-c, tím nižší kardiovaskulární riziko. Dosahování hladin LDL-c dokonce pod 1,5 mmol/l u pacientů s velmi vysokým kardiovaskulárním rizikem nejen neškodí, ale prospívá.
Obrázek č. 1: Riziko velké vaskulární příhody podle dosažené hladiny LDL-c ve statinových studiích.

* Adjustováno na věk, pohlaví, kuřáctví, přítomnost diabetu mellitu, systolický tlak krve, koncentraci HDL-c.
S přibývajícími důkazy o pozitivním vlivu velice nízkých hladin LDL-c na kardiovaskulární zdraví stále klesají cílové hodnoty, kterých se terapií snažíme docílit. Ještě v roce 1994 doporučoval konsenzus evropských odborných společností jako cílovou hodnotu LDL-c pro pacienty s manifestním KVO koncentraci nižší než 3,0 mmol/l (9), zatímco v současné době jsou dle doporučení EAS/ESC z roku 2016 pro stejně rizikového nemocného cílové koncentrace LDL-c alespoň pod 1,8 mmol/l – viz tabulka č. 2 (10). Tento posun je důsledkem klinických studií, které prokázaly zlepšení prognózy spolu s výrazným poklesem hladin LDL-c. Za zmínku jistě stojí sledování vlivu velmi nízkých hladin LDL-c na KV prognózu u nemocných s hladinami LDL-c pod 1,5 mmol/l léčených v ambulantní péči v průběhu dvou let, kdy podávání statinů vedlo k nižší celkové mortalitě i v případě dosažení velice nízkých hladin LDL-c pod 1,0 mmol/l (10). Ve studii ASTEROID bylo podáváním maximální dávky rosuvastatinu dosaženo průměrné hladiny LDL-c 1,55 mmol/l, přičemž se zmenšil celkový objem ateromového plátu hodnocený intravaskulárním ultrazvukem (11). Podobných studií je celá řada, a není tedy nouze o opakovaně potvrzený pozitivní efekt snižování koncentrací LDL-c i pod úroveň dnes doporučovaných cílových hodnot.
Tabulka č. 2: Cílové hodnoty LDL-c v prevenci KVO podle (9) – doporučení ESC/EAS z roku 2016.
Dávkování statinů
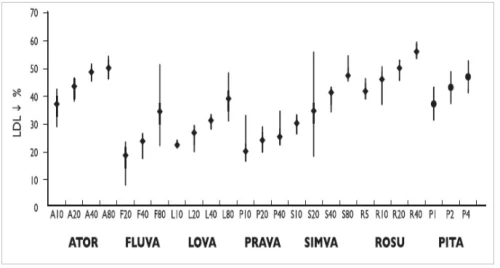
Ačkoli jsou v rámci prevence KVO statiny široce užívanou skupinou léčiv, jejich dávka není často dostatečná a koncentrace LDL-c se v mnoha případech ani neblíží cílovým hodnotám. Více než polovina pacientů užívá dávku 20 mg statinu (atorvastatinu, rosuvastatinu, simvastatinu), která ovšem nemusí být pro konkrétního pacienta zdaleka dostačující, a profitoval by z intenzivnější léčby. Maximální možnou dávku atorvastatinu 80 mg má pouze minimum nemocných (3,5 %), 40 mg rosuvastatinu 10,1 % pacientů, přičemž průměrná hladina LDL-c u osob v sekundární prevenci ischemické choroby srdeční je 2,37 mmol/l (12) – dle současných doporučení by měla být koncentrace LDL-c u pacientů v sekundární prevenci alespoň nižší než 1,8 mmol/l.
Z přiloženého grafu je patrné, že snížení hladin LDL-c o 50 % je možné dosáhnout pouze intenzivní hypolipidemickou léčbou – atorvastatinem 40–80 mg a rosuvastatinem 20–40 mg, simvastatin 80 mg již dále nepoužíváme pro významně vyšší riziko nežádoucích svalových účinků ve srovnání s výše uvedenými možnostmi léčby (viz graf č. 1).
Graf č. 1 – pokles LDL-c při různých dávkách statinů.
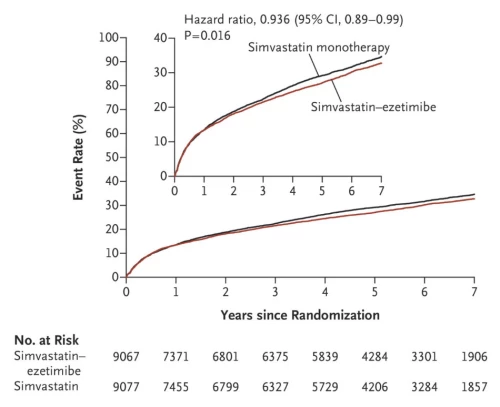
V současné době je často vznášen dotaz, jak intenzivní léčbu volit a jaké koncentrace LDL-c jsou žádané, případně pro pacienta bezpečné. Opakovaně bylo prokázáno, že KV riziko lineárně klesá spolu se snižováním koncentrací LDL-c i v oblasti velice nízkých hladin LDL-c. Ve studii IMPROVE-IT byli pacienti po akutním koronárním syndromu léčeni pouze 40 mg simvastatinu či v kombinaci s ezetimibem, přičemž ve větvi léčené kombinační terapií měli nemocní signifikantně nižší hladiny LDL-c (v průměru 1,4 mmol/l) a současně o 6,4 % nižší relativní riziko rozvoje KV příhody (6) – viz graf č. 2.
Graf č. 2 – kumulativní riziko KV příhod u větve léčené pouze 40 mg simvastatinu ve srovnání s kombinační léčbou s ezetimibem (6).
U kterých pacientů indikovat vysoké dávky statinu?
Mezi nemocné, kteří významně profitují z intenzivní hypolipidemické léčby, a snažíme se u nich tedy docílit velice nízkých hladin LDL-c, patří především pacienti s velmi vysokým KV rizikem – po prodělání akutního koronárního syndromu, revaskularizaci atd. – a také nemocní s familiární hypercholesterolemií.
Pacienti po prodělaném akutním koronárním syndromu (AKS) mají dle doporučení Evropské kardiologické společnosti z roku 2016 užívat maximální tolerovanou dávku statinu bez ohledu na vstupní hodnoty lipidogramu, čímž se výrazně snižuje riziko rozvoje dalších KV příhod (10). U nás bylo již v roce 2012 publikováno společné stanovisko České společnosti pro aterosklerózu a pracovní skupiny akutní a intervenční kardiologie České a Slovenské kardiologické společnosti, které tuto praxi doporučuje explicitně (13). U každého takového pacienta je nezbytné zahájit terapii 80 mg atorvastatinu či 40 mg rosuvastatinu již první den hospitalizace pro AKS, pokud nejsou přítomné kontraindikace. Nižší dávku statinu volíme v případě vyšší pravděpodobnosti rozvoje nežádoucích účinků – u pacientů s hepatopatií (jaterní testy nad trojnásobkem referenčních hodnot), terminálním renálním selháním, polypragmazií, nedostatečně substituovanou hypotyreózou, starších 80 let, drobnějších pacientů a nemocných užívajících verapamil, makrolidová antibiotika, imunosupresiva či jiná hypolipidemika (fenofibrát). Ve všech zmíněných případech zahajujeme léčbu nižší dávkou statinu. Pokud již má nemocný anamnézu myopatie po statinu, upřednostníme nejnižší dostupnou dávku jiného statinu. Léčbu nezahajujeme u pacientů s LDL-c pod 1,8 mmol/l (což je ovšem velice vzácné), při anamnéze závažné myopatie v důsledku užívání statinu a u nemocných s očekávanou délkou života kratší než 6 měsíců.
Po propuštění z nemocnice je třeba pod dohledem ambulantního lékaře v tomto dávkování statinů pokračovat, a to u všech pacientů bez ohledu na lipidogram. Další přehodnocení stavu je namístě až po 6–8 týdnech, přičemž cílem je udržet dostatečné dávkování statinů, které má u pacientů po AKS prokázaný přínos. Nejlepších výsledků bylo ve studiích s pacienty po AKS dosaženo při podávání 80 mg atorvastatinu či 40 mg rosuvastatinu, a proto je tyto léky třeba považovat za terapii 1. volby. Naprosto zásadní je uvést do propouštěcí zprávy cílovou hodnotu LDL-c pod 1,8 mmol/l, což je koncentrace, které se snažíme dosáhnout u všech pacientů v sekundární prevenci. Pokud se této cílové hodnoty nedaří dosáhnout monoterapií statiny, lze do léčby přidat také ezetimib.
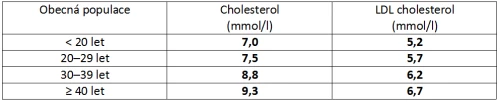
Familiární hypercholesterolemie (FH) je autozomálně dominantně dědičné onemocnění s předčasnou manifestací aterosklerózy u homozygotů ve 2.–3. dekádě a u heterozygotů ve 3.–4. dekádě. Takové pacienty je nutné v populaci cíleně vyhledávat a včas zahájit intenzivní léčbu, abychom byli schopni zabránit rozvoji KVO nebo jejich manifestaci co možná nejvíce oddálit. Léčba této skupiny nemocných, jejichž vstupní hodnoty LDL-c bývají velmi vysoké, je ve valné většině případů založena na nejvyšší možné dávce atorvastatinu či rosuvastatinu, případně v kombinaci s ezetimibem.
Problematice FH se v Česku dlouhodobě věnuje projekt MedPed (odvozeno z anglického make early diagnosis to prevent early deaths in medical pedigrees; 14). V březnu 2014 vznikla v České republice také pacientská organizace s názvem Diagnóza FH, jejímž cílem je zlepšit informovanost pacientů i veřejnosti o problematice familiární hypercholesterolemie.
Tabulka č. 3 – MedPed kritéria diagnózy FH.
Je intenzivní hypolipidemická léčba bezpečná?
V souvislosti s podáváním vysokých dávek statinů se objevují obavy ohledně bezpečnosti této léčby. Rozsáhlé výsledky ovšem potvrzují významně vyšší účinnost vysokých dávek spojenou s pouze mírným nárůstem rizika. Srovnání bezpečnosti atorvastatinu v dávce 80 mg a 10 mg v analýze 49 dokončených studií zahrnujících sledování 14 236 pacientů ukázalo velmi nízký výskyt myalgií při obou dávkách atorvastatinu i při podávání placeba (15; viz graf č. 3). Rozdíly mezi skupinami byly minimální: výskyt léčbou indukovaných myalgií činil 1,4 % při dávce atorvastatinu 10 mg, 1,5 % při dávce 80 mg a 0,7 % u placeba.
Graf č. 3 – výskyt myalgie při léčbě atorvastatinem 10 mg a 80 mg ve srovnání s placebem.

Při léčbě 80 mg atorvastatinu je riziko zvýšení jaterních transamináz mírně vyšší, studie zabývající se touto otázkou ovšem prokázala, že elevace alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST) jsou vzácné (16). Odborné společnosti v současnosti doporučují vyšetření transamináz před zahájením léčby, při první kontrole léčeného pacienta a dále pouze v případě potřeby.
Samy velmi nízké hladiny LDL-c také budí rozporuplné názory a mnoho studií se zabývalo otázkou jejich bezpečnosti. Skutečností je, že celoživotně velice nízké koncentrace LDL-c, podmíněné genetickými odchylkami urychlujícími katabolismus LDL částic (hypobetalipoproteinemie), nejsou spojené s poškozením žádného orgánového systému, ba co víc, nositelé takových genetických variant se dožívají vyššího věku a jejich riziko ischemické choroby srdeční je ve srovnání s běžnou populací o 70–80 % nižší (17).
Řada studií v nedávné době zjišťovala vliv velice nízkých hladin LDL-c na zdraví pacientů. Na tomto místě je nezbytné zmínit studii FOURIER, první z těch, které sledují efekt PCSK9 inhibitorů (v tomto případě evolocumabu) na výskyt KVO ve srovnání s placebem (18). Autoři zjistili, že přidání PCSK9 inhibitoru ke statinu má za následek o 59 % větší pokles LDL-c (koncentrace LDL-c průměrně 0,78 mmol/l), ale také 15% redukci výskytu KV příhod – toto je naprosto zásadní výstup, který opakovaně potvrzuje tezi „čím níže, tím lépe“ v případě LDL-c. Mezi větvemi pacientů, kteří užívali účinnou látku a placebo, nebyl pozorovaný žádný rozdíl ve výskytu nežádoucích účinků s výjimkou reakce v místě vpichu (o 0,5 % více u pacientů léčených evolocumabem). Studie FOURIER nás opět utvrdila v názoru, že velmi nízké hladiny LDL-c jsou bezpečné a především prospěšné pro velmi vysoce rizikové pacienty.
Při hypolipidemické léčbě je nezbytné vždy pacienta poučit o možných vedlejších účincích léčby, v případě výskytu nežádoucích účinků s pacientem příznaky podrobně probrat a pokusit se obtíže nemocného objektivizovat. Samozřejmostí je zopakování laboratorních testů s kontrolou kreatinkinázy a jaterních transamináz, podle výsledků a intenzity obtíží poté zhodnotíme poměr prospěchu a rizika léčby a zvážíme, jak nadále postupovat. Terapii můžeme dočasně přerušit, vyčkat normalizace stavu i laboratorních hodnot a pokusit se o terapii jinou účinnou látkou s titrací od nejnižších možných dávek, eventuálně zvolit netradiční (tzv. alternativní) dávkování, které ještě pacient bez obtíží toleruje (např. 5 mg rosuvastatinu dvakrát týdně). Dále je vhodné nízké dávky statinu při nedosažení cílových hodnot kombinovat se sezetimibem, případně do terapie přidat omega-3 mastné kyseliny (v kontextu hypertriglyceridemie vhodné podávání farmakologických dávek) či zvýšení příjmu rostlinných sterolů. Nastavení terapie při skutečné intoleranci některého ze statinů může být někdy nesnadné, především z důvodu neochoty pacientů zkoušet další preparáty a potažmo být znovu vystaven riziku myalgií. V tomto případě neztrácíme trpělivost a pacientům opakovaně zdůrazňujeme nezbytnost léčby a veškerá rizika vyplývající z ukončení hypolipidemické terapie. Jistě v těchto případech může pomoci specializované pracoviště sledující takové pacienty.
Závěr
Léčbu dyslipidemie v rámci prevence KVO musíme indikovat včas a vybírat nejúčinnější statin v dostatečné dávce. Podle kontrolních laboratorních hodnot lipidogramu dále titrujeme léčbu k maximální možné/tolerované dávce statinu k dosažení cílových hodnot LDL-c dle individuálního KV rizika. Statiny, zejména pokud jsou podávány v sekundární prevenci, nevysazujeme a terapii ani krátkodobě nepřerušujeme, jedná se o celoživotní terapii.
- Soška V., Vaverková H., Vrablík M. et al. Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2011. DMEV 2013; 16 : 24–29.
- The Emerging Risk Factors Collaboration Major lipids, apolipoproteins and risk ofvascular disease: individual data analysis of 302,430 participants from 68 prospective studies. JAMA 2009, 302 : 1993–2000.
- Goff D. C., Lloyd-Jones D. M., Bennett G. et al. 2013 ACC/AHA Guideline on the Assessment of Cardiovascular Risk. J Am Coll Cardiol 2013: S0735–1097.
- Stone N. J., Robinson J., Lichtenstein A. H. et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults. J Am Coll Cardiol 2013, pii: S0735–1097.
- Leeper N. J., Ardehali R., de Goma E. M. et al. Statin Use in Patients With Extremely Low Low-Density lipoprotein Levels Is Associated With Improved Survival. Circulation2007, 116 : 613–618.
- Cannon C. P., Blazing M. A., Giugliano R. P. et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015. 372 : 2387–97.
- CTT Collaborators. Lancet 2012; 380 : 581.
- Boekholdt S. M., Hovingh G. K., Mora S. et al. Very low levels of atherogenic lipoproteins and the risk for cardiovascular events: a meta-analysis of statin trials. J Am Coll Cardiol 2014, 64 : 485–94.
- Pyörälä K., De Backer G., Graham I. et al. Prevention of coronary heart disease in clinical practice: recommendations of the taskforce of the European Society of cardiology, European atherosclerosis Society and European society of Hypertension. Atherosclerosis 1994, 110 : 121–161.
- Catapano A. L., Graham I., De Backer G. et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. EHJ 2016; 253 : 281–344.
- Nissen S. E., Nicholls S. J., Sipahi I. et al Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006, 295 : 1556–65.
- Hradec J, Bultas J, Kmínek A, et al. Jak se léčí statiny v České republice? Výsledky průzkumu STEP. Cor Vasa 2011; 53 : 527–534.
- Piťha J. et al. Léčba statiny u pacientů s akutním koronárním syndromem. Interv Akut Kardiol 2012; 11 (2): 89–90.
- www.medped.cz
- Newman C. et al. Comparative Safety of Atorvastatin 80 mg Versus 10 mg Derived from Analysisof 49 Completed Trials in 14,236 Patients; Am J Cardiol 2006; 97 : 61–67.
- LaRosa J. C., Grundy S. M., Waters D. D., et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005 Apr 7; 352 (14): 1425–35.
- Berge K. E., Ose L., Leren T. P. Missense mutations in the PCSK9 gene are associated with hypocholesterolemia and possibly increased response to statin therapy. Arterioscler Thromb Vasc Biol 2006, 26 : 1094–100.
- Sabatine M. S., Giugliano R. P., Keech A. C. et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017; 376 : 1713–1722.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



