-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNobelova cena letos udělena za objevy vedoucí k vývoji mRNA vakcín
9. 10. 2023
Letošní Nobelovu cenu za fyziologii či medicínu získali Katalin Karikó a Drew Weissman za své objevy modifikací nukleosidových bází, které umožnily vývoj účinných mRNA vakcín.
Dlouhá cesta od krav ke koronaviru
Termín „vakcína“ poprvé použil v 18. století Edward Jenner. Odvodil ho z latinského vacca, tj. kráva. Jenner experimentoval s imunizací proti pravým neštovicím pomocí inokulace materiálem z lézí kravských neštovic a jeho metoda očkování se ukázala jako účinná. Po necelém století na tento úspěch navázal Louis Pasteur, který vyvinul živou atenuovanou vakcínu proti vzteklině.
V 19. století byla objevena řada mikroorganismů a teorie o infekčním původu onemocnění začala být všeobecně uznávaná. Na začátku 20. století byly vyvinuty první vakcíny založené na oslabených bakteriálních toxinech (toxoidech), což umožnilo očkování proti záškrtu a tetanu. S rozvojem laboratorních metod bylo ve 30. letech 20. století možné zavést metodiku kultivace virů na chorioalantoidních membránách kuřecích embryí a podařilo se připravit vakcínu proti chřipce či žluté zimnici. Se zavedením tkáňových kultur do praxe pak nastal bouřlivý rozvoj očkování proti virům zahájený vakcínou proti poliomyelitidě, následovaly očkovací látky proti spalničkám, zarděnkám, příušnicím a planým neštovicím. [1]
Přínos molekulární biologie
Pokroky v molekulární genetice umožnily vývoj vakcín založených na jednotlivých složkách virů. K imunizaci lze využít virové proteiny připravené rekombinantními technikami, tedy překladem části virového genomu a izolací výsledného proteinu z tkáňové kultury. Takto se připravuje například vakcína proti hepatitidě B nebo lidskému papilomaviru (HPV).
Alternativně je možné vyhnout se přípravě virového proteinu tím, že se část genetické informace patogenního viru přenese do neškodného virového nosiče, tzv. vektoru. Po injekci vektoru nesoucího genetickou informaci patogenu do lidského organismu dochází k produkci virového proteinu přímo v lidských buňkách a nastartuje se imunitní reakce. Na tomto principu funguje například vakcína proti ebole.
Výroba vakcín založených na celých virech nebo jejich proteinech i produkce vektorových vakcín však vyžaduje použití velkoobjemových tkáňových kultur. To je velmi náročné na lidské i finanční zdroje a limitující pro rychlou odpověď při epidemiích. Vědci se proto již dlouhou dobu snažili vyvinout technologie výroby vakcín nezávislé na tkáňových kulturách. [2]
Jak využít molekulárního poslíčka?
Genetická informace pro výrobu proteinů zakódovaná v deoxyribonukleové kyselině (DNA) se v buňkách nejprve přepisuje do tzv. mediátorové ribonukleové kyseliny (messenger RNA – mRNA), která se poté využívá jako templát pro syntézu proteinů. Již v 80. letech 20. století byly vyvinuty metody pro produkci mRNA mimo buňky, tzv. in vitro transkripce. Vzápětí se začaly rodit nápady na její využití v medicíně, ale objevilo se mnoho překážek.
In vitro připravená mRNA se považuje za nestabilní a její podání do organismu vyžadovalo vývoj sofistikovaných lipidových vehikul. Takto připravená mRNA také způsobuje zánětlivé reakce. Nadšení pro klinický vývoj technologií založených na mRNA zůstávalo poněkud vlažné.
Klíčové objevy
Biochemička Katalin Karikó se však nenechala odradit a na počátku 90. let při svém působení na Pensylvánské univerzitě navázala spolupráci s imunologem Drewem Weissmanem. Společně se zaměřili na mechanismy, jimiž různé typy RNA interagují s imunitním systémem.
Objevili, že dendritické buňky, které zastávají důležité funkce v procesech imunitní surveillance a aktivace imunitní odpovědi indukované vakcínami, rozpoznávají in vitro transkribovanou mRNA jako cizí látku. To vede k jejich aktivaci a uvolnění zánětlivých signálních molekul. Proč se však tělo brání mRNA připravené in vitro, když mRNA ze savčích buněk zánětlivou reakci nespouští?
Modifikace bází a zánětlivá odpověď
Karikó a Weissman si uvědomili, že nukleosidové báze v RNA ze savčích buněk jsou často chemicky modifikované, zatímco mRNA připravená in vitro obsahuje pouze „základní“ báze adenin, uracil, guanin a cytosin. Aby otestovali hypotézu, že právě absence chemických modifikací bází je zodpovědná za zánětlivou reakci, připravili různé varianty mRNA s různými chemickými modifikacemi a zkoumali reakci dendritických buněk. Výsledky byly pozoruhodné – po zahrnutí modifikovaných bází do mRNA zánětlivá reakce téměř vymizela (viz obr.). Tento převratný objev byl publikován v roce 2005. [3]
Obr. Modifikace ribonukleosidových bází blokuje sekreci mediátorů zánětlivé reakce a zvyšuje produkci překládaného proteinu.
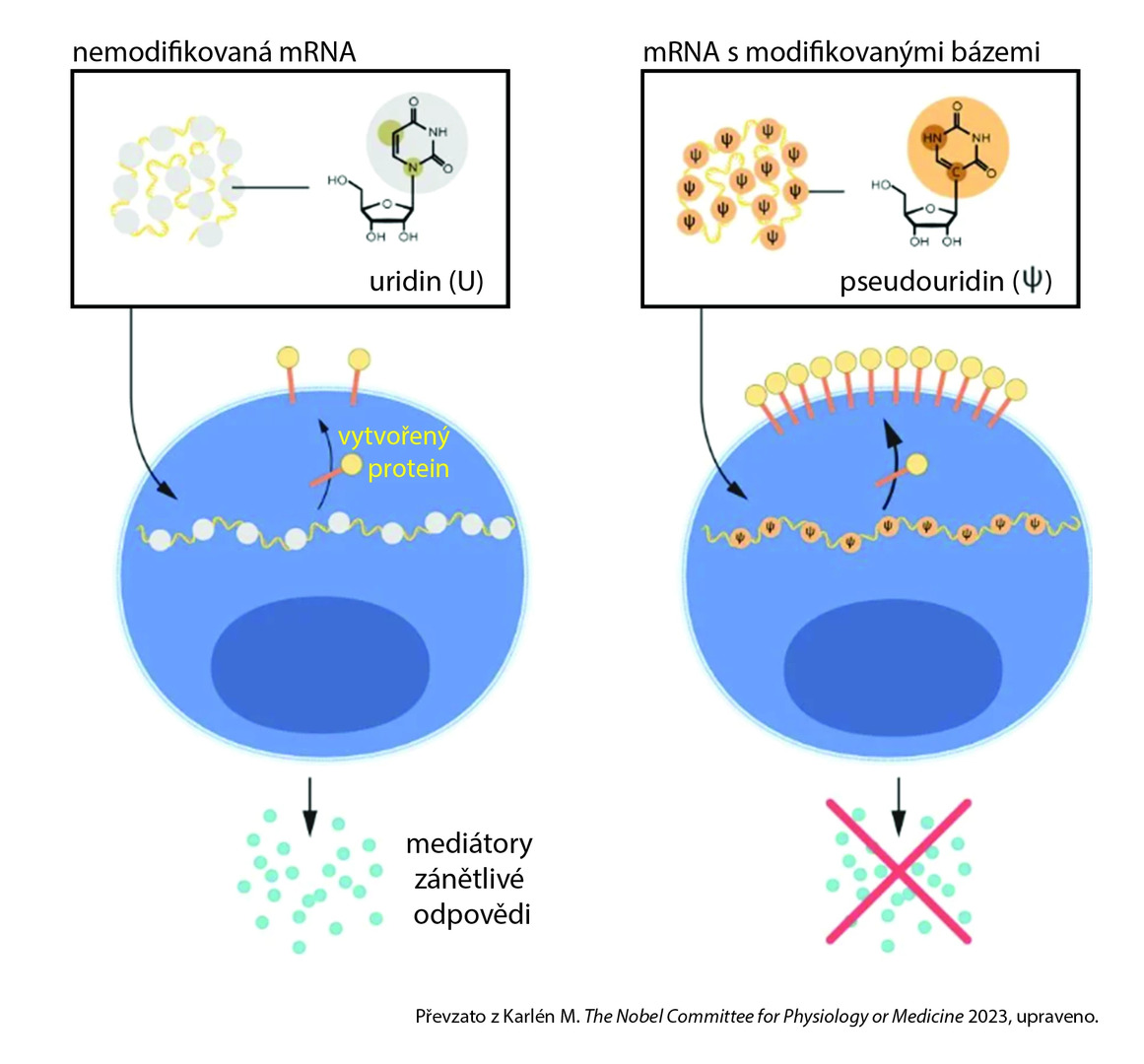
Ve svých dalších studiích Karikó s Weismanem ukázali, že podání mRNA připravené s modifikovanými bázemi vedlo ke značně zvýšené produkci proteinů oproti nemodifikované mRNA. [4, 5] Modifikace nukleosidových bází tedy odstranila zásadní překážky na cestě ke klinické aplikaci mRNA.
První mRNA vakcíny
V roce 2010 pracovalo na mRNA vakcínách několik biotechnologických společností. Vyvíjena byla například vakcína proti viru zika nebo viru blízkovýchodního respiračního syndromu (MERS). Po vypuknutí pandemie COVID-19 na jaře roku 2020 se v rekordní době podařilo připravit dvě mRNA vakcíny s modifikovanými bázemi založené na povrchových proteinech viru SARS-CoV-2. Jak fungují, jsme srozumitelně přiblížili v jednom z našich dřívějších článků.
Flexibilita a rychlost zachraňují životy
Hlavní výhodou technologie in vitro přípravy mRNA vakcín je flexibilita a rychlost, s jakou mohou být vyvinuty. S využitím této technologické platformy se počítá ve vývoji vakcín proti jiným infekčním onemocněním a v budoucnu se očekává i možnost jejího využití pro cílené podání terapeutických proteinů nebo pro léčbu některých typů nádorových onemocnění.
(este)
Zdroje:
1. Saleh A., Qamar S., Tekin A. et al. Vaccine development throughout history. Cureus 2021; 13 (7): e16635, doi: 10.7759/cureus.16635.
2. The Nobel Prize in physiology or medicine 2023. The Nobel Assembly at Karolinska Institutet, 2023 Oct 02. Dostupné na: www.nobelprize.org/prizes/medicine/2023/press-release
3. Karikó K., Buckstein M., Ni H., Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23 (2): 165–175, doi: 10.1016/j.immuni.2005.06.008.
4. Karikó K., Muramatsu H., Welsh F. A. et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 2008; 16 (11): 1833–1840, doi: 10.1038/mt.2008.200.
5. Anderson B. R., Muramatsu H., Nallagatla S. R. et al. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res 2010; 38 (17): 5884–5892, doi: 10.1093/nar/gkq347.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
KongresyOdborné události ze světa medicíny
Všechny kongresy
Nejčtenější tento týden- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Vakcinace stojí díky inovativním technologiím na prahu nové éry
- Návykové látky a prekurzory v magistraliter receptuře
- Prof. Jan Škrha: Metformin je bezpečný, ale je třeba jej bezpečně užívat a léčbu kontrolovat
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



