-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZářící léčba karcinomu prostaty s českou stopou
25. 4. 2022
Radiofarmakum PSMA-617, které významně prodlužuje kvalitní život mužům s metastatickým kastračně rezistentním karcinomem prostaty, bylo v této indikaci na konci března schváleno americkým Úřadem pro kontrolu potravin a léčiv (FDA). O „své molekule“ s námi hovořila Mgr. Martina Benešová, Ph.D., která stojí za vznikem vůbec první schválené cílené radioligandové léčby nádorů prostaty.

Můžete nám na úvod přiblížit, jak léčivo funguje?
Jako první bychom měli říci, že se jedná o takzvané teranostikum, což znamená, že se může použít jak pro diagnostiku, tedy pro zobrazování nádoru prostaty, tak také pro samotnou léčbu. Rozdíl je pouze v tom, který radionuklid je do farmaka inkorporován.
V praxi to vypadá tak, že pro diagnostiku pomocí pozitronové emisní tomografie (PET) se PSMA-617 nejčastěji značí galliem-68. Následně se připraví stejné farmakum s luteciem-177, případně s aktiniem-225, které se poté intravenózně aplikuje do těla pacienta. Tam se akumuluje úplně stejně jako diagnostická varianta a při tom ničí metastázy karcinomu prostaty.
Co rozhoduje o tom, který radionuklid je optimální pro dané využití?
PSMA-617 je nádherná molekula, protože má speciální chelátor, který je schopen „držet“ různé radionuklidy, nejen dva či tři, ale prakticky celé portfolio.
Zmíněné lutecium-177 je relativně měkký β-zářič, který se používá pro malé, dobře definované metastázy. Je to i velmi dobře přístupný radionuklid, dá se jednoduše koupit.
Pokud má pacient relativně velké nádorové masy, využívá se zpravidla yttrium-90, které patří také mezi β-zářiče, ale má mnohem vyšší energii než lutecium a delší dosah v tkáni.
Aktinium-225 přichází na řadu, pokud má pacient zničenou kostní dřeň. Jakožto α-zářič má totiž velmi krátký dosah, a tak se akumuluje v kostních metastázách, ale neničí dále kostní dřeň. Aktinium se také používá u pacientů, kteří jsou neskutečně rezistentní a nereagovali dobře na terapii s β-zářiči. V mnoha případech pak na léčbu silnějším radionuklidem začnou reagovat.
Obr. 1 Molekula PSMA-617. Chelátor, tedy část molekuly schopná vázat ionty radiokovů (X), zvýrazněn červeně.
(Zdroj: Eppard et al., 2017)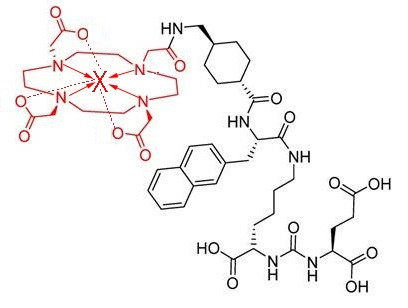
Zjednodušeně si tedy můžeme molekulu PSMA-617 představit jako takový batůžek, který nese správný zářič na místo určení?
Ano. PSMA-617 velmi dobře cílí na buňky karcinomu prostaty, což zlepšuje terapeutické okno a přináší dobrý bezpečnostní profil. Lékaři vidí velmi rychlou a stabilní akumulaci v nádorových buňkách, ale na druhou stranu i velmi rychlé vyloučení farmaka ze všech orgánů, převážně z ledvin.
Jak probíhá léčba pomocí PSMA-617 v praxi?
Zpravidla se každé 2 měsíce intravenózně podá 3 až 6 cyklů – podle toho, jak pacient na léčbu reaguje. Reakce se kontroluje PET diagnostikou, řekněme po prvních 3 cyklech. Takže je to relativně jednoduchá, přímá, hezká kombinační metoda.
U kterých pacientů s karcinomem prostaty je tato léčba vhodná?
Zatím se používá u těch, kteří již vyzkoušeli veškeré dostupné schválené léčebné režimy. Někteří za sebou mají až 40 nebo 50 cyklů chemoterapie, která už vůbec nepůsobí, mají zničenou kostní dřeň. PSMA-617 je schopné i tyto pacienty nějakým − minimálně paliativním − způsobem léčit. Obrovská bolest, kterou zažívají kvůli metastázám v kostech, prakticky vymizí. U některých vidíme kompletní remisi a jsou „čistí“ řadu měsíců až několik let, jak zatím můžeme pozorovat.
V současnosti běží další studie fáze III, jež budou testovat, zda nemá smysl endoradioterapii nasadit ještě před chemoterapií. Dokonce se rozjíždí i studie, která testuje účinnost endoradioterapie již v 1. linii léčby u pacientů s předpokladem rezistence k hormonální terapii.
Obr. 2 Snímek roku 2018 dle Společnosti pro nukleární medicínu a molekulární zobrazování (SNMMI). Pozitronová emisní tomografie 8 pacientů s metastatickým karcinomem prostaty, u nichž byly vyčerpány standardní léčebné postupy, před léčbou PSMA-617 a 3 měsíce poté. Autorem snímku je tým výzkumníků pod vedením prof. Michaela Hofmana z Centra pro výzkum nádorových onemocnění Petera McCalluma v Melbourne.
(Zdroj: Hofman et al., 2018)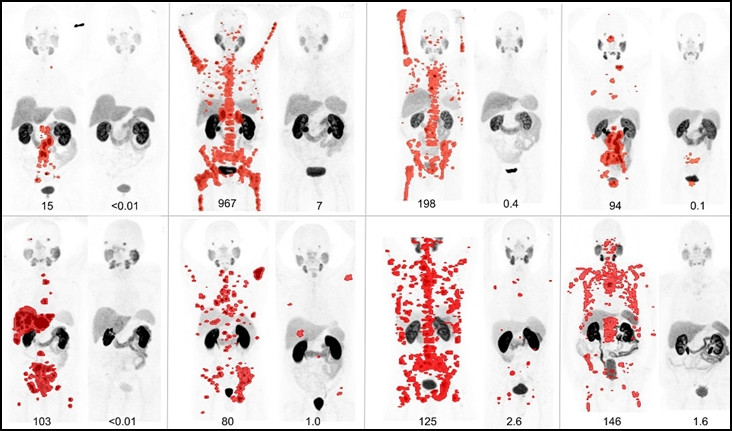
Jak se taková molekula, jedna z milionu, dostane od laboratorního stolu až k pacientům?
Sama pořád říkám, že to byla klika jak od vozu. Je důležité být ve správný čas na správném místě. Skupina v Německém centru pro výzkum nádorových onemocnění v Heidelbergu, kde jsem začala svou doktorskou práci, měla k dispozici diagnostický ligand PSMA-11, který v pacientech vypadal velmi dobře. Mým úkolem bylo na tuto práci navázat a vytvořit farmakum použitelné pro diagnostiku i terapii karcinomů prostaty, což pro mě jako jaderného chemika bylo velmi zajímavé. Velkou výhodou bylo, že jsem nepociťovala žádný velký tlak na výsledek, jako mají farmaceutické firmy nebo významní profesoři, kteří musejí dokazovat, že si zaslouží své financování. Já si spokojeně v laborce připravovala spoustu různých farmak.
Německé centrum pro výzkum nádorových onemocnění sídlí ve stejném kampusu jako univerzitní klinika s oddělením nukleární medicíny, které má úžasného vedoucího lékaře. Podle německé legislativy je možné na osobní zodpovědnost lékaře aplikovat pacientovi, samozřejmě s jeho souhlasem, jakékoliv experimentální léčivo. Náš lékař na ústavním semináři viděl preklinické výsledky, které ukazovaly, že PSMA-617 po 1 hodině od podání myškám ukazuje obrovskou akumulaci jen v nádoru a nikde jinde, ani v ledvinách ne. Rozhodl, že je čas vyzkoušet farmakum u lidí. První diagnostický sken vypadal velmi dobře a nedlouho nato klinika našla i vhodného pacienta pro terapeutickou aplikaci. Léčbu pro prvního pacienta jsme přenesli podzemním tunelem z našeho ústavu přímo na univerzitní kliniku.
A pak už to jelo neskutečnou rychlostí, nejen v Německu, ale na všech světadílech kromě Antarktidy. Potenciál farmaka nejprve rozpoznala menší německá firma, která začala s výrobou a prodejem. Poté licenci odkoupila větší firma, která začala financovat klinické zkoušky, a následně ji převzala společnost Novartis, jež dotáhla klinické hodnocení až do III. fáze – a nakonec k autorizaci FDA. V brzké době se očekává i schválení v Evropské unii, Kanadě a Velké Británii.
I přes obrovské úspěchy PSMA-617 se zdá, že endoradioterapie jako léčebná modalita stojí tak trochu v pozadí. Hodně se mluví spíše o cílené léčbě monoklonálními protilátkami nebo o imunoterapii.
Na jednu stranu jsme tak trochu outsideři, na druhou stranu je třeba zmínit, že nukleární medicína byla uznána jako samostatný lékařský obor až v 70. letech 20. století – ten je tedy sám o sobě velmi mladý. Fakt, že používáme radioaktivitu, taky není úplně nápomocný, protože má celkově nedobré renomé. Důležitá a limitující je i nutná speciální infrastruktura. Diagnostika a terapie se dá aplikovat pouze v nemocnicích s oddělením nukleární medicíny.
Nicméně doufám, že právě příklad PSMA-617 v budoucnu otevře nové možnosti a výrazně rozšíří možnosti aplikace nukleární medicíny. Klinická studie VISION je považovaná za jeden z největších úspěchů v historii nukleární medicíny. Osobně věřím, že v budoucnu bude endoradioterapie běžnou součástí kombinované léčby nádorů.
Eva Stejskalová
redakce MeDitorial***************
Co je PSMA-617?
Společnost Novartis 23. 3. 2022 oznámila schválení radiofarmaka [177Lu]Lu-PSMA-617 (Lu-177 vipivotid tetraxetan), prodávaného pod obchodním názvem PluvictoTM. Americký Úřad pro kontrolu potravin a léčiv (FDA) jej schválil v indikaci léčby progresivního metastatického kastračně rezistentního karcinomu prostaty s pozitivitou prostatického specifického membránového antigenu (PSMA) u dospělých pacientů, kteří byli léčeni inhibitory androgenů a chemoterapií založenou na taxanech.
Schválení vychází z výsledků mezinárodní otevřené klinické studie fáze III VISION, jíž se účastnilo 831 pacientů předléčených nejméně 1 inhibitorem dráhy androgenových receptorů a 1−2 taxanovými režimy. Přidání [177Lu]Lu-PSMA-617 ke standardní péči signifikantně prodloužilo jak přežití bez progrese onemocnění (medián 8,7 vs. 3,4 měsíce; poměr rizik [HR] pro progresi či úmrtí 0,40; p < 0,001), tak také celkové přežití (medián 15,3 vs. 11,3 měsíce; HR 0,62; p < 0,001). Incidence nežádoucích příhod stupně ≥ 3 byla vyšší ve skupině s radiofarmakem (52,7 vs. 38,0 %), neměla však negativní účinek na pacienty udávanou kvalitu života.
Reference:
1. Novartis Pluvicto™ approved by FDA as first targeted radioligand therapy for treatment of progressive, PSMA positive metastatic castration-resistant prostate cancer. Novartis, 2022 Mar 23. Dostupné na: www.novartis.com/news/media-releases/novartis-pluvictotm-approved-fda-first-targeted-radioligand-therapy-treatment-progressive-psma-positive-metastatic-castration-resistant-prostate-cancer
2. Sartor O., de Bono J., Chi K. N. et al. Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385 (12): 1091−1103, doi: 10.1056/NEJMoa2107322.
3. Eppard E., de la Fuente A., Benešová M. et al. Clinical translation and first in-human use of [44Sc]Sc-PSMA-617 for PET imaging of metastasized castrate-resistant prostate cancer. Theranostics 2017; 7 (18): 4359−4369, doi: 10.7150/thno.20586.
4. Hofman M. S., Violet J., Hicks R. J. et al. [177Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study. Lancet Oncol 2018; 19 (6): 825−833, doi: 10.1016/S1470-2045(18)30198-0.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
KongresyOdborné události ze světa medicíny
Všechny kongresy
Nejčtenější tento týden- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Vakcinace stojí díky inovativním technologiím na prahu nové éry
- Návykové látky a prekurzory v magistraliter receptuře
- Prof. Jan Škrha: Metformin je bezpečný, ale je třeba jej bezpečně užívat a léčbu kontrolovat
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



