-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStanovenie vareniklínu v lieku Champix® dvojdimenzionálnou kapilárnou elektroforézou v spojení s UV detekciou
Determination of varenicline in the preparation Champix® with the use of two-dimensional capillary electrophoresis in connection with UV detection
This paper deals with an analytical method based on two dimensional capillary electrophoresis (CITP-CZE coupling) with simple UV-detection for the determination of a highly effective drug – varenicline. The method was elaborated with the possibility of its future connection with an advanced detection ending – mass spectrometry. The electrolytes for the CITP (LE = 10 mM NH4Ac + 5 mM HAc + 0,05% m-HEC; TE = 10 mM HAc) and CZE (BGE = 20 mM HAc) separation of varenicline were selected considering such requirements. The UV detector was set at the constant wavelength of 237 nm. The presented CITP-CZE-UV combination enabled rapid and effective evaluation of varenicline in the dosage forms with LOD 5.92 ng/ml.
Keywords:
nicotine, varenicline, two dimensional capillary electrophoresis, dosage forms, pharmacy
Autoři: Juraj Piešťanský; Katarína Maráková; Lucia Veizerová; Jaroslav Galba; Peter Mikuš
Působiště autorů: Bratislava, Slovenská republika ; Katedra farmaceutickej analýzy a nukleárnej farmácie FaF UK
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 270-275
Kategorie: Původní práce
Souhrn
Práca sa zaoberá vývojom analytickej metódy na báze dvojdimenzionálnej kapilárnej elektroforézy (spojenie CITP-CZE) s jednoduchou UV-detekciou pre stanovenie vysokoúčinného farmaka – vareniklínu s možnosťou spojenia vypracovanej metódy s pokročilou detekčnou koncovkou – hmotnostným spektrometrom. Na základe takto koncipovaných požiadaviek boli zvolené optimálne elektrolytové systémy pre CITP (LE = 10 mM NH4Ac + 5 mM HAc + 0,05% m-HEC; TE = 10 mM HAc) a CZE (BGE = 20 mM HAc) separáciu vareniklínu. Detekcia bola uskutočnená pri vlnovej dĺžke 237 nm. Uvedené spojenie umožnilo rýchle a efektívne hodnotenie vareniklínu v jeho tabletovej liekovej forme s medzou dôkazu (LOD) na úrovni 5,92 ng/ml.
Kľúčové slová:
nikotín, vareniklín, dvojdimenzionálna kapilárna elektroforéza, liekové formy, farmáciaÚvod
Vstup tabaku do civilizovaného sveta koncom 15. storočia znamenal i vzostup kultúry fajčenia. Fajčenie tabaku sa stalo spoločnosťou akceptovanou závislosťou a v súčasnosti patrí medzi jeden z hlavných predispozičných faktorov, ktoré výrazne zhoršujú zdravie obyvateľstva a sú zodpovedné za jeho zvýšenú morbiditu a mortalitu, a to najmä z hľadiska ochorení ako sú rakovina pľúc, chronická bronchitída alebo ischemická choroba srdca1). Hlavnou obsahovou látkou v tabaku, ktorá zodpovedá za jeho účinky je nikotín – alkaloid odvodený od kyseliny nikotínovej2). V organizme sa viaže na nikotínové receptory, a tak sa zúčastňuje cholinergnej transmisie. V nízkych dávkach pôsobí nikotín stimulačne, vo vyšších vyvoláva útlm parasympatikového nervstva. Na nikotín vzniká psychická i fyzická závislosť3).
Odvykanie od fajčenia a liečba nikotínovej závislosti je veľmi náročný proces a veľa fajčiarov svoj cieľ nenaplní. Je možné ju uskutočniť aj farmakologicky. V praxi uplatnenie našla náhradná nikotínová terapia, kedy sa nikotín v odstupňovaných dávkach aplikuje vo forme liečivej žuvačky, pastilky alebo náplasti. Liečivo amfebutamón (bupropion) s antidepresívnym účinkom zvyšuje schopnosť pacientov abstinovať. Mechanizmus tohto účinku nie je známy, ale predpokladá sa zásah do dopaminergnej transmisie v mezolimbickom systéme4). V prípade liečby nikotínovej závislosti sa uvažuje i o použití tricyklického antidepresíva nortriptilínu alebo centrálneho antihypertenzíva klonidínu5). Perspektívu vo farmakoterapii nikotínovej závislosti predstavuje i liečivo vyvinuté cielene pre tento účel – vareniklín.
Liečivo vareniklín je odvodené od alkaloidu cytizínu7) získavaného z Cytisus laburnum L. (Fabaceae), ktorý pôsobí ako agonista na nikotínových cholinergných receptoroch. Vareniklín (8,9,10-tetrahydro-6,10-metano--6H-pyrazino[2,3-h][3]benzazepín) vo forme soli s tartarátom (obr.1) bol schválený pre terapiu nikotínovej závislosti a v roku 2006 registrovaný americkou FDA pod ochranným názvom Chantix, v Európe bol registrovaný úradom EMA pod ochranným názvom Champix8). Vareniklín pôsobí ako parciálny agonista α4β2 nikotínových acetylcholínových receptorov situovaných vo ventrálnej tegmentálnej oblasti mozgu. Obsadenie α4β2 receptorov spôsobí ich čiastočnú aktiváciu a spúšťa sled biochemických procesov, ktoré vedú k čiastočnej stimulácii dopaminergnej transmisie v mezolimbickom systéme. Samotnému dopamínu a dopaminergnej transmisii v tejto časti mozgu je prisudzovaná hlavná úloha a zodpovednosť za určitý pocit odmeny, blaha a slasti u fajčiara po vyfajčení cigarety9).
Obr. 1. Chemická štruktúra vareniklín tartarátu<sup>6)</sup> 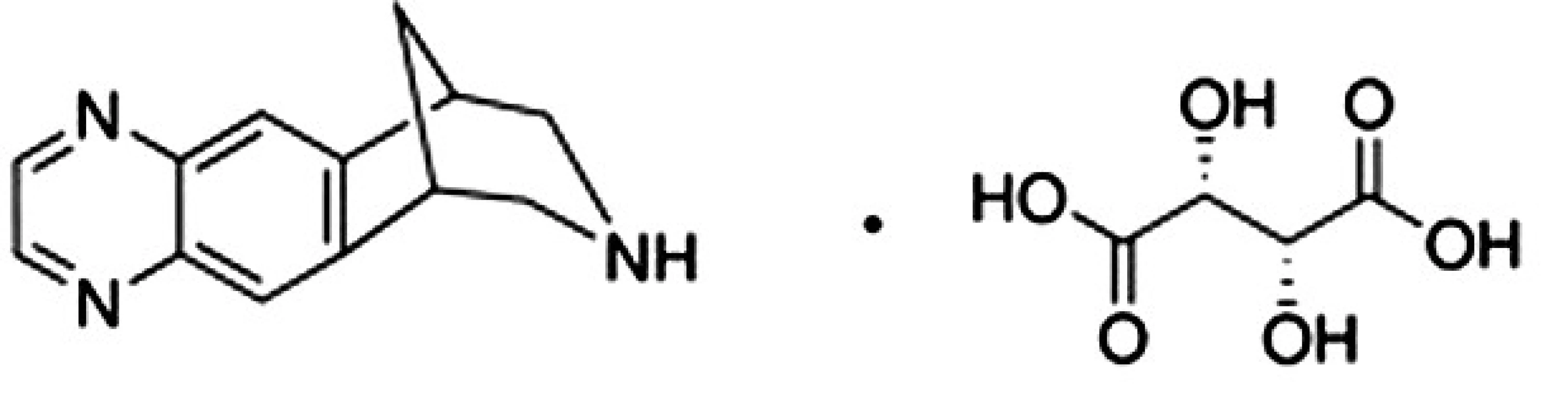
S vareniklínom ako vysokoúčinným liečivom je spojené i riziko vzniku závažných nežiaducich účinkov, ktoré sú charakterizované zmenami v správaní a/alebo myslení, depresiami, agresívnym správaním, nestabilitou nálady, suicídnymi myšlienkami a dokonca i pokusmi o samovraždu. Z tohto dôvodu je potrebné dôkladné sledovanie pacientov v priebehu ich odvykacej liečby. V takýchto prípadoch sa nápomocnými na klinických pracoviskách stávajú separačné analytické metódy umožňujúce rýchle monitorovanie hladín liečiv v biologických tekutinách. Okrem biomedicínskej aplikácie je možné dané analytické metódy implementovať i do prostredia samotnej výroby a prípravy liečiv a liekov, kde efektívny proces separácie v kombinácii s vhodnou detekčnou technikou prispieva k zabezpečovaniu ich najvyššej akosti. Dominantnými sa vo farmaceutickej oblasti stali chromatografické metódy, a to na základe ich jednoduchosti a kváziuniverzality. Podnetnými a v súčasnosti stále viac sa rozvíjajúcimi sú elektromigračné metódy v kapilárnom prevedení – najmä kapilárna elektroforéza (CE), ktorá sa v spojení s vysokocitlivými a selektívnymi detekčnými technikami môže stať alternantívou k bežným konvenčným chromatografickým systémom.
Na hodnotenie liečiva vareniklínu a jeho nečistôt v liekovej forme tabliet boli použité viaceré analytické metódy, predovšetkým však chromatografické10–16). Technikami HPLC a RP-HPLC v spojení s UV-detekciou boli dosiahnuté medze dôkazu (LOD) na úrovni 0,003 μg/ml11); 0,11 μg/ml12); resp. 0,31 μg/ml13). LC v spojení s tandemovou hmotnostnou spektrometriou (MS/MS) bola zase použitá pre stanovenie vareniklínu v ľudskej plazme a liekovej forme, pričom vypracovaná metóda poskytovala LOD 6,0 ng/ml15). Rovnaké spojenie bolo použité i pri bioekvivalenčnej štúdii dvoch komerčných prípravkov s obsahom vareniklínu v krvnej plazme16). Popísané bolo i spojenie CE s DAD detekciou pre stanovenie obsahu vareniklínu v tabletách, pričom medza dôkazu sa pohybovala na úrovni 0,2 μg/ml17). Aleksic a kol.18) použili voltametrické techniky pre stanovenie vareniklínu v roztokoch a vzorkách plazmy.
Z uvedených faktov z odbornej literatúry vyplýva, že okrem jedného prípadu11) doteraz nebola prezentovaná taká analytická metóda, ktorou by bez použitia vysokocitlivej detekčnej techniky bolo možné dosiahnuť mimoriadne nízke (jednotky ng/ml a nižšie) LOD pre vareniklín. Perspektívnou sa v tomto ohľade stáva dvojdimenzionálna (2D) CE kombinujúca v sebe techniky kapilárnej izotachoforézy (CITP) a kapilárnej zónovej elektroforézy (CZE). Použitie CITP ako predseparačnej techniky umožňuje zvýšenie dávkovaného množstva do elektroforetického analyzátora až na 30 μl, odstránenie nežiaducich makrokomponentov matrice a z toho vyplývajúce prečistenie a predúpravu vzorky. CZE v ďalšom kroku plní vlastnú analytickú úlohu s prepojením na vhodnú detekčnú koncovku. Takéto 2D usporiadanie umožňuje niekoľkonásobné zníženie medze dôkazu, a to už pri použití jednoduchej UV detekcie v porovnaní s CZE v jednokolónovom usporiadaní. Naviac významne zvyšuje separačné možnosti (separačnú selektivitu) v porovnaní s jednokolónovou ITP19). Preto cieľom našej práce bolo vyvinúť CITP-CZE metódu pre ultrastopové stanovenie vareniklínu. Z dôvodu zvýšenia aplikačného potenciálu navrhnutej metódy bolo vybrané kritérium jej kompatibility nielen s UV absorpčnými detektormi, ale aj s detektormi na báze hmotnostnej spektrometrie, ktoré vďaka ich priamej identifikačnej schopnosti patria ku kľúčovým detekčným systémom súčasnosti. Toto kritérium bolo zohľadnené pri optimalizácii separačných podmienok pre CITP-CZE.
Pokusná časť
Inštrumentácia
Na prevedenie experimentálnej práce bol použitý elektroforetický analyzátor EA 102 (Villa Labeco, Spišská Nová Ves, Slovensko) v dvojkolónovom usporiadaní umožňujúcom CITP-CZE analýzu. CITP separačnú jednotku tvorila polytetrafluóretylénová kapilára s vnútorným priemerom 800 μm a dĺžkou 90 mm umiestnená v bloku so zabudovaným vodivostným detektorom. CZE separačná jednotka pozostávala z polytetrafluóretylénovej kapiláry s vnútorným priemerom 300 μm a dĺžkou 90 mm umiestnenej v bloku so zabudovaným vodivostným detektorom a UV koncovkou. Vzorka bola do analyzátora dávkovaná prostredníctvom dávkovacieho bloku so zabudovanou 30 μl vnútornou slučkou.
K analyzátoru bol prostredníctvom UV koncovky CZE bloku a optických vláken (J & M, Aalen, Nemecko) pripojený UV detektor (ECOM, Praha, Česká republika), ktorý bol nastavený na konštantnú vlnovú dĺžku (237 nm) zodpovedajúcu absorpčnému maximu analyzovanej látky. Údaje získavané z analyzátora boli zaznamenávané a vyhodnocované prostredníctvom softvérového programu Aces (Prírodovedecká fakulta UK, Bratislava, Slovensko).
Chemikálie a vzorky
Na prípravu roztokov elektrolytových systémov, ktoré boli volené tak, aby boli kompatibilné súčasne i s MS detekciou, sa použili octan amónny (NH4Ac), mravčan amónny (NH4Fo), kyselina octová (HAc) a kyselina mravčia (HFo) (Sigma Aldrich, Steinheim, Nemecko). Všetky uvedené chemikálie mali požadovanú p.a. analytickú čistotu. Elektrolytové systémy boli pripravené rozpustením uvedených chemikálií v demineralizovanej vode pripravenej pomocou deionizačného systému Millipore Simplicity 185 (Lambda Life, Bratislava, Slovensko). Roztoky elektrolytov boli pred ich použitím filtrované membránovými filtrami s veľkosťou pórov 0,45 μm (Millipore, Molsheim, Francúzsko). Referenčný štandard vareniklín tartarát s deklarovanou čistotou ≥ 98% bol získaný z firmy Sigma Aldrich (Steinheim, Nemecko). V prípade CITP separačného kroku bola do vodiaceho elektrolytu (LE) pridávaná metyl-hydroxyetylcelulóza (m-HEC) s koncentráciou 0,05% (w/v) (Fluka, Buchs, Švajčiarsko). Lieková forma (tablety Champix®) s obsahom vareniklínu (výrobcom deklarovaný obsah 1 mg v jednej tablete) bola získaná z miestnej lekárne.
Príprava roztokov štandardov a vzoriek
Základný roztok štandardu vareniklínu sme pripravili rozpustením 5 mg štandardu v 10 ml demineralizovanej vody. Pracovné roztoky štandardov o požadovanej koncentrácii (koncentračný rozsah 20–500 ng/ml) sme pripravili riedením základného roztoku štandardu demineralizovanou vodou.
Pri príprave vzorky liekovej formy sme jednotlivo odvážili hmotnosť piatich tabliet lieku Champix® a následne sme vypočítali priemernú hmotnosť jednej tablety (0,2092 g). Odvážené tablety sme rozpráškovali v trecej miske. Z takto homogenizovanej vzorky sme do 100 ml odmernej banky navážili hmotnosť zodpovedajúcu priemernej hmotnosti jednej tablety lieku Champix®, ktorú sme doplnili po rysku demineralizovanou vodou a 10 minút mechanicky pretrepávali. Roztok vzorky sme potom počas 20 minút nechali v ultrazvukovom kúpeli, následne sme takto upravený roztok riedili demineralizovanou vodou tak, aby koncentrácia analytu zodpovedala úrovni 100 ng/ml a pred analýzou filtrovali membránovými filtrami s veľkosťou pórov 0,45 μm.
Príprava vzoriek pre hodnotenie výťažnosti
Pre hodnotenie výťažnosti sme do roztoku reálnej matrice so zodpovedajúcou koncentráciou analytu 100 ng/ml pridávali štandardný prídavok vareniklínu. Pripravili sme tri vzorky s koncentráciami pridaného roztoku štandardu vareniklínu na úrovni 20, 100 a 500 ng/ml a jednu vzorku bez prídavku štandardu. Všetky vzorky boli následne mechanicky pretrepávané počas 10 minút a pred vlastnou analýzou filtrované cez membránové filtre s veľkosťou pórov 0,45 μm.
Výsledky a diskusia
Optimalizácia separačných podmienok pre CITP-CZE experiment
Optimalizácia separačných podmienok v sebe zahŕňa voľbu elektrolytových systémov pre CITP a CZE a súčasne i nastavenie hodnôt vodiaceho prúdu pre jednotlivé kroky. Zloženie elektrolytov a veľkosť aplikovaných prúdov sú volené zo zreteľom na rýchlosť a účinnosť analýzy, minimalizáciu tepelných a elektromigračných disperzných procesov a kompatibilitu spájaných techník. Z pohľadu elektroforetickej separácie sme tak museli brať do úvahy vlastnosti jednotlivých kombinovaných techník (CITP, CZE), pričom optimalizácia separačných podmienok zohľadňovala i možnosť použitia CITP-CZE metódy v spojení s hmotnostnou detekciou (MS). V takomto prípade musela byť splnená podmienka prchavosti elektrolytových systémov. V našej práci sme testovali nasledovné elektrolytové systémy, ktorých zloženie je zhrnuté v tabuľke 1.
Tab. 1. Prehľad testovaných elektrolytových systémov pre separáciu vareniklínu 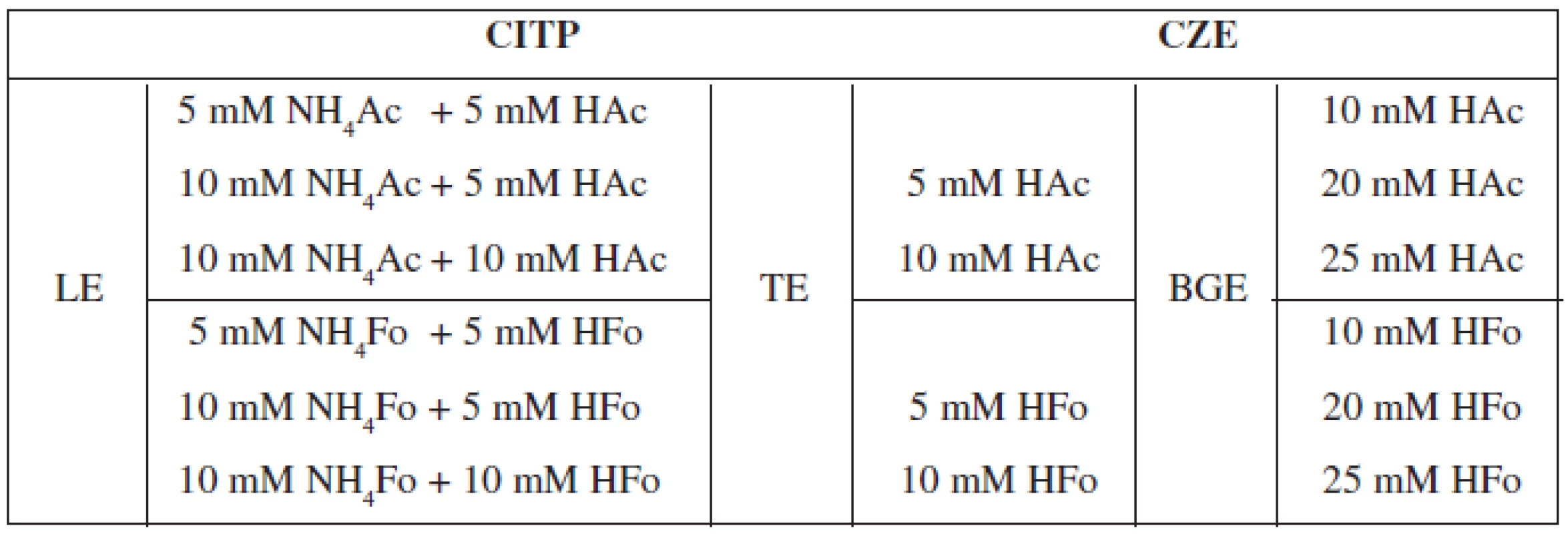
CITP – kapilárna izotachoforéza, CZE – kapilárna zónova elektroforéza, LE – vodiaci elektrolyt, TE – zakončujúci elektrolyt, BGE – základný (nosný) elektrolyt Z uvedených testovaných elektrolytových systémov sa ako optimálny ukázal CITP-CZE systém s nasledovným zložením: a) LE = 10 mM NH4Ac + 5 mM HAc (pH 4,9), b) TE = 10 mM HAc (pH 3,1) a c) BGE = 20 mM HAc (pH 2,8). Súčasťou zvoleného vodiaceho elektrolytu bola i 0,05% m-HEC, ktorá zabezpečovala dynamické pokrytie CITP separačnej kapiláry, čím sa bránilo adhézii analytu na jej povrch a zároveň slúžila ako supresor elektroosmotického toku (EOF). Pre separáciu vareniklínu v CITP kroku sa ukázal byť vhodný vodiaci prúd 300 μA, v CZE kroku 40 μA. Takto zvolené separačné podmienky viedli k úspešnej separácii analytu z matríc testovaných vzoriek, a to s dostatočnou účinnosťou (N) v relatívne krátkom čase (viď Validácia metódy).
Validácia metódy
Validácia analytickej metódy predstavuje proces jej overovania, pri ktorom sa zisťuje vhodnosť zvolenej metódy pre daný zamýšľaný účel. Nami navrhnutú a optimalizovanú CITP-CZE metódu sme validovali na základe odporúčaní ICH smernice20). Hodnotené boli nasledovné parametre: linearita; presnosť (vyjadrená ako opakovateľnosť); medza dôkazu (LOD); medza stanovenia (LOQ); robustnosť; správnosť. Niektoré z uvedených validačných parametrov sú obsahom tabuľky 2.
Tab. 2. Vybrané operačné a validačné parametre CITP-CZE metódy 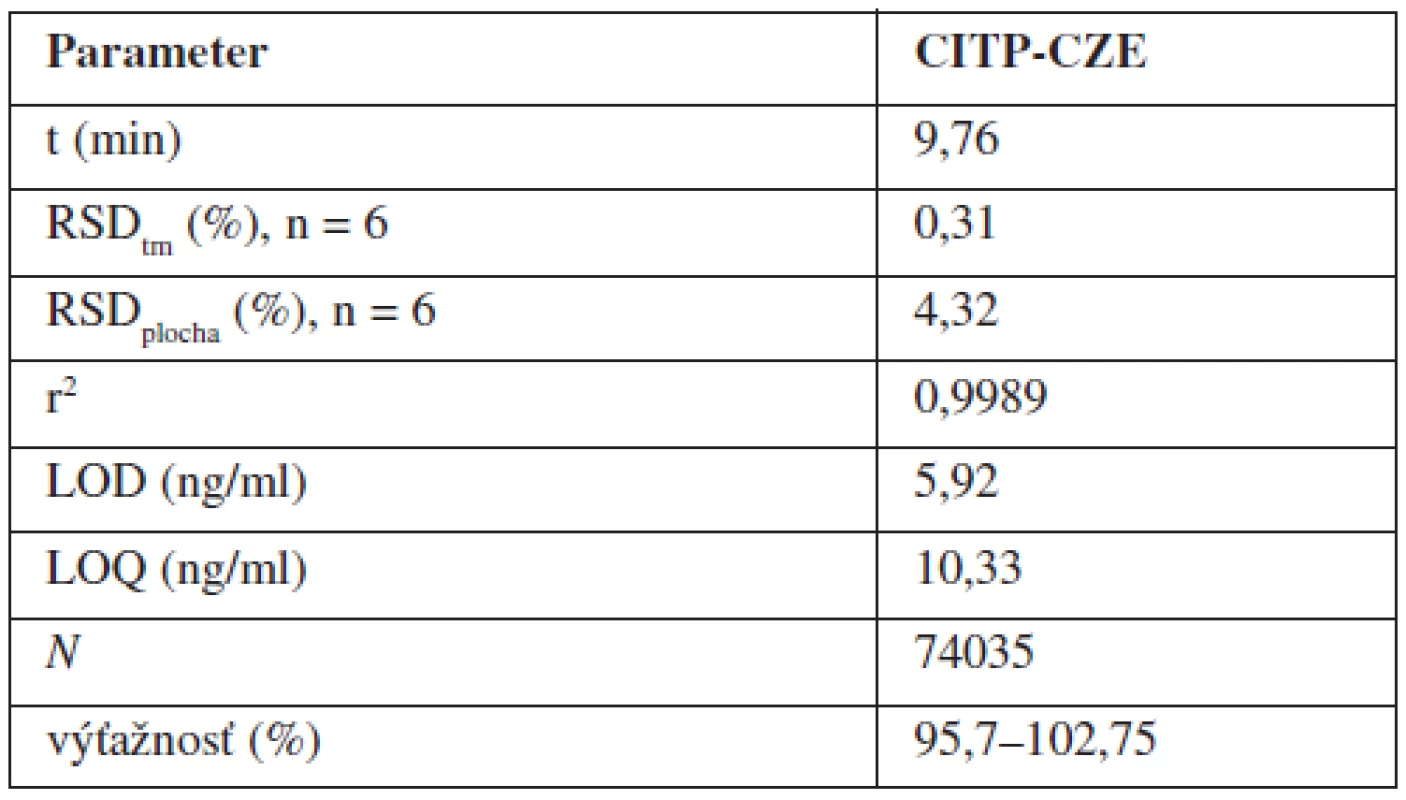
Linearita navrhnutej CITP-CZE metódy bola hodnotená meraním piatich rôznych koncentrácií roztoku štandardu vareniklínu, a to v rozmedzí 20–500 ng/ml (obr. 2a). Každá z piatich vzoriek bola premeraná 6-krát, pričom s použitím nameraných výsledkov bola zostrojená kalibračná krivka vyjadrujúca závislosť plochy analytického signálu od koncentrácie {AU=f(c)}. Parametre kalibračnej krivky boli hodnotené s použitím softvérového programu Microsoft Excel 2007 (Microsoft Corporation, Redmond, WA, USA). Rovnica kalibračnej krivky bola y = 26,39x–56,219, pričom hodnoty korelačného koeficientu (r) a koeficientu stanovenia (r2) hovoria o dobrej linearite kalibračnej krivky v zvolenom koncentračnom rozmedzí.
Obr. 2. Elektroforeogramy validačného procesu CITP-CZE metódy: a) roztoky štandardu vareniklínu o rôznej koncentrácii (testovanie linearity); b) testovanie výťažnosti. Detekcia v CZE kroku bola uskutočnená s nastavenou vlnovou dĺžkou 237 nm. Použité vodiace prúdy boli 300 μA (CITP) a 40 μA (CZE). Ostatné separačné podmienky sú uvedené v časti Optimalizácia separačných podmienok pre CITP-CZE experiment. 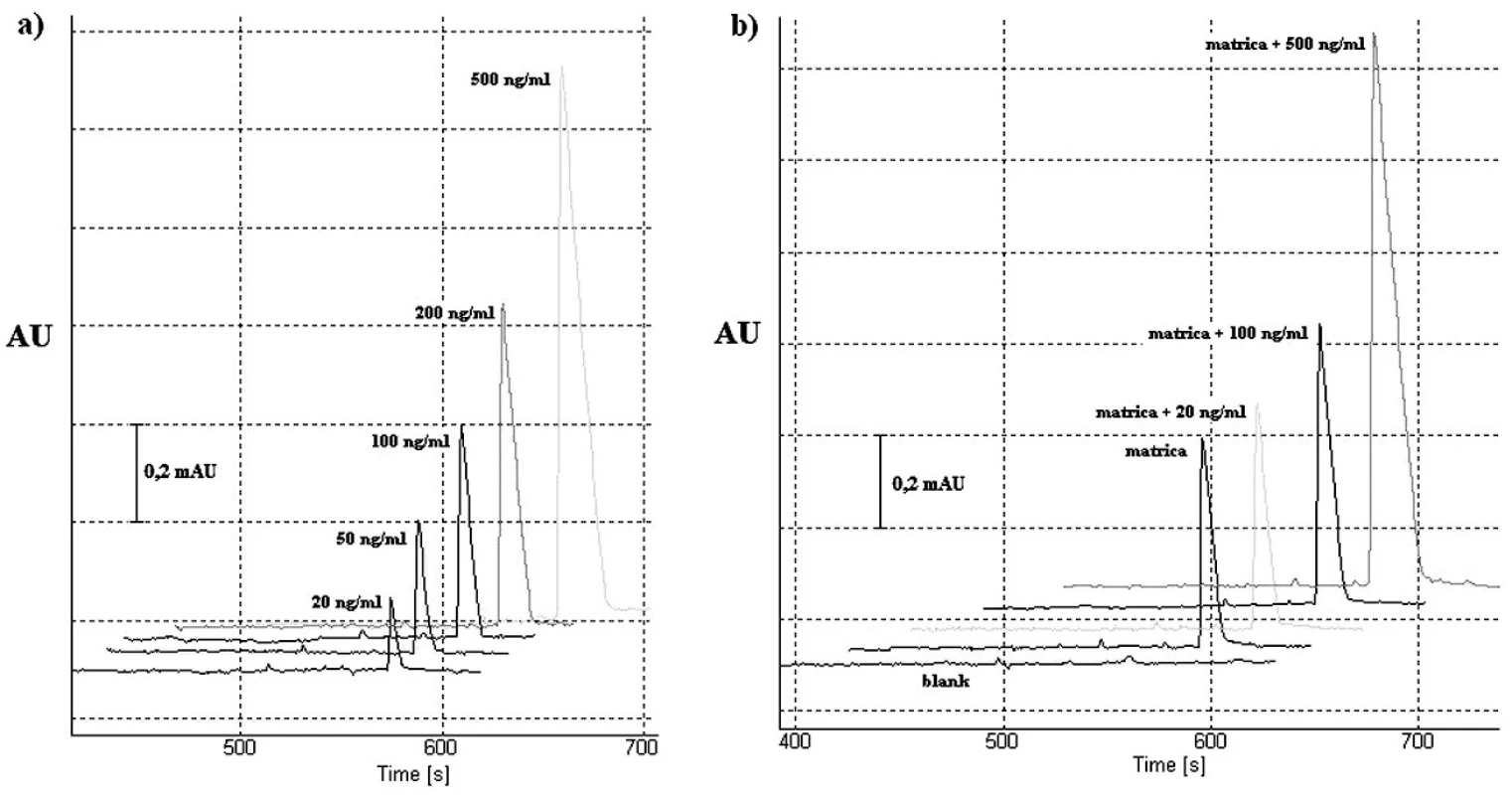
Medza dôkazu (LOD) ako najnižšia koncentrácia analyzovanej látky, ktorá je pri danej hladine spoľahlivosti ešte detegovateľná a medza stanovenia (LOQ) ako najnižšia koncentrácia analytu stanoviteľná s prijateľnou hodnotou presnosti boli vypočítané na základe stanovenia signálu slepej vzorky (demineralizovaná voda) pre desať meraní (n = 10). Z uvedených meraní bol určený priemerný signál slepej vzorky (x0) a jeho smerodajná odchýlka (s), ktoré boli použité pri získaní veľkosti signálu detektora pre LOD {y(D)} a LOQ {y(Q)} na základe vzťahov: y(D) = x0 + 3.s, resp. y(Q) = x0 + 10.s. LOD a LOQ boli následne vypočítané z kalibračnej krivky. LOD na úrovni 5,92 ng/ml je približne na úrovni LOD, ktorý bol dosiahnutý s použitím HPLC v spojení s tandemovou hmotnostnou spektrometriou ako detekčnou koncovkou15).
Presnosť vyjadrená ako opakovateľnosť bola určená ako relatívna štandardná odchýlka (RSDplocha) plôch analytického signálu a migračných časov (RSDtm) vzoriek s koncentráciou v rozsahu kalibračnej krivky, ktoré boli premerané šesťkrát (opakované meranie jednej koncentrácie roztoku štandardu). Dosiahnuté výsledky RSD hovoria o vhodne zoptimalizovanom analytickom systéme a jeho dobrej opakovateľnosti.
Robustnosť predstavuje mieru citlivosti a stability metódy voči malým zmenám v operačných parametroch. V našej práci sme pre test robustnosti menili koncentráciu základného (nosného) elektrolytu HAc v rozmedzí 18–22 mM. Zmena uvedeného parametra neviedla k výrazným zmenám v priebehu analýzy a k jej výsledkom a metóda bola osvedčená ako dostatočne robustná.
Správnosť CITP-CZE metódy sme hodnotili na základe výťažnosti, ktorá bola prevedená prostredníctvom štandardného prídavku roztoku štandardu vareniklínu o troch rôznych koncentráciách do roztoku matrice – tabletovej liekovej formy (viď časť Príprava vzoriek pre hodnotenie výťažnosti). Získané analytické signály (obr. 2b) zodpovedajúce fortifikovanej matrici boli konfrontované s matricou samotnou. Výťažnosť bola počítaná: výťažnosť (%) = {[c(prídavku v testovanej vzorke) – c(analytu v testovanej vzorke bez prídavku)] / c(prídavku v referenčnej vzorke)}.100. Získané výsledky indikujú akceptovateľnú správnosť použitej metódy.
Aplikácia CITP-CZE metódy vo farmácii pre hodnotenie kvality liečiv a liekov
Navrhnutú a validovanú CITP-CZE-UV metódu sme aplikovali pri hodnotení obsahu účinnej látky – vareniklínu v tabletovej liekovej forme Champix® (obr. 3). Výrobca na náš farmaceutický trh dodáva liek s príslušným názvom v sile 1 mg (obsah liečiva v jednej tablete). Priemerný obsah vareniklínu v danej liekovej forme sa pohyboval na úrovni 1,008 mg, pričom RSD zo šiestich paralelných meraní bola 1,84 %. Výrobcom deklarovaný obsah je v zhode s nami dosiahnutými výsledkami, na základe čoho možno potvrdiť jednak kvalitu hodnoteného lieku a na strane druhej vhodnosť vypracovanej 2D-CE metódy pre tento účel.
Obr. 3. Záznamy z priamej CITP-CZE analýzy vzorky liekovej formy vareniklínu: a) porovnanie izotachoforeogramov štandardu látky (horný záznam) s reálnou vzorkou (dolný záznam); b) elektroforeogram z CZE kroku separácie vzorky s približnou koncentráciou 100 ng/ml VAR – vareniklín, * – potenciálna nečistota, resp. degradačný produkt, LE – vodiaci elektrolyt, TE – zakončujúci elektrolyt Detekcia v CZE kroku bola uskutočnená pri konštantnej vlnovej dĺžke 237 nm. Použité vodiace prúdy boli 300 μA (CITP) a 40 μA (CZE). Ostatné separačné podmienky sú uvedené v časti Optimalizácia separačných podmienok pre CITP-CZE experiment. 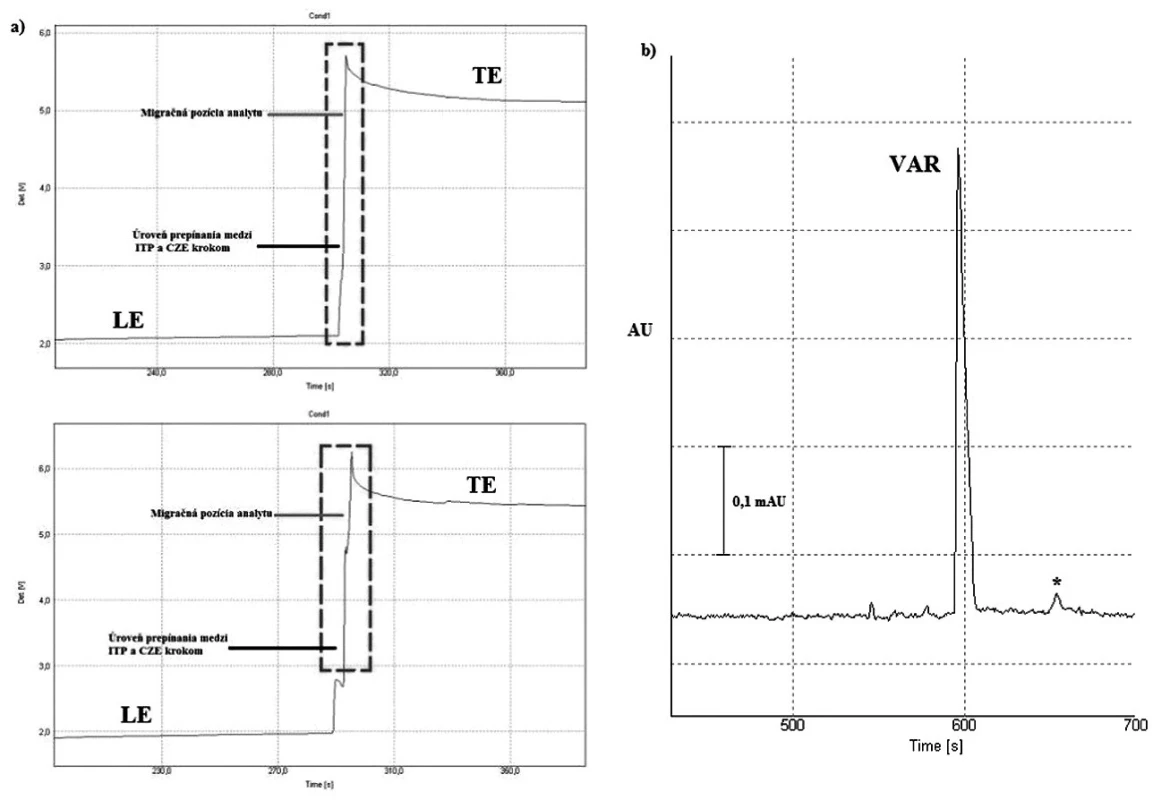
Záver
Cieľom práce bolo navrhnutie, vypracovanie a validácia 2D-CE metódy s jednoduchou UV detekciou pre možnosti stanovenia obsahu liečiva vareniklínu v tabletovej liekovej forme dostupnej na európskom trhu s liekmi. Optimalizovaná CITP-CZE-UV metóda s použitím jednoduchých elektrolytových systémov bola validovaná s dobrou linearitou v rozsahu koncentrácií 20–500 ng/ml. Úplná separácia sa dosiahla v čase kratšom ako 10 minút. 2D-CE v spojení s UV detekciou tak predstavuje rýchlu a najmä lacnú analytickú metódu, ktorá sa na základe validačného procesu vyznačuje i vysokou účinnosťou, robustnosťou a citlivosťou. Zo získaných výsledkov vyplýva, že CITP-CZE je vhodnou alternatívnou a/alebo komplementárnou metódou v porovnaní s HPLC, ktorú predčuje najmä v jednoduchosti, ekologickosti, nákladoch na analýzu a separačnej účinnosti. Z pohľadu farmaceutického priemyslu a praxe tak do budúcnosti môže znamenať perspektívny prístup k hodnoteniu kvality liečiv a liekov, štúdiu ich farmakokinetiky a degradácie. Jednoduchosť použitých prchavých elektrolytových systémov 2D-CE zároveň vytvára reálny predpoklad pre jej on-line spojenie s MS detekciou, ktoré by z pohľadu vareniklínu mohlo viesť k efektívnemu hodnoteniu liečiva samotného, avšak i k detailnému popisu profilu nečistôt obsiahnutých v liečive, resp. jeho degradačných produktov.
Poďakovanie
Autori ďakujú PharmDr. Michalovi Piešťanskému za darovanie lieku Champix®.
Stret záujmov: žiadny.
Došlo 15. oktobra 2013
Prijato 30. októbra 2013
PharmDr. Juraj Piešťanský (∗) • K. Maráková • L. Veizerová • J. Galba • P. Mikuš
Katedra farmaceutickej analýzy a nukleárnej farmácie FaF UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: piestansky@fpharm.uniba.sk
Zdroje
1. Mackey J., Eriksen M. The tobacco atlas. 1. vyd. London: Myriad Editions Limited 2002.
2. Tomko J. Farmakognózia. 2. vyd. Martin: Osveta 1999.
3. Lüllmann H., et al. Farmakologie a toxikologie. 15. vyd. Praha: Grada Publishing 2004.
4. Tønnesen P. Smoking cessation: How compelling is the evidence? A review. Health Policy 2009; 91, 15–25.
5. Caponnetto P., Russo C., Polosa R. Smoking cessation: present status and future perspectives. Curr. Opin. Pharmacol. 2012; 12(3), 229–237.
6. www.sigmaaldrich.com/catalog/product/SIGMA/PZ0004?lang= eng®ion=SK
7. Serafini A., Crespel A., Velizara R., Gelisse P. Varenicline-induced grand mal seizure. Epileptic Disord. 2012; 12(4), 338.
8. Rao J., Shankar P. K. Varenicline: For smoking cessation. Kathmandu Univ Med J 2009; 7(2), 162–164.
9. Kavcová E. Vareniklín – nová možnosť v liečbe nikotínovej závislosti. Via pract 2008; 5(7/8), 308–312.
10. Satheesh B., Kumarpulluru S., Raghavan V., Saravanan D. UPLC Separation and quantification of related substances of varenicline tartrate tablet. Acta Chromatogr 2010; 22 (2), 207–218.
11. Channabasavaraj K. P., Jagadish S. M., Sharath H. M. Development and validation of RP-HPLC method for estimation of varenicline tartrate in bulk drug and tablet dosage form. Int J Pharm Pharm Sci 2011; 3(2), 59–61.
12. Kadi A. A., Mohamed M. S., Kassem M. G., Darwish I. A. A validated stability-indicating HPLC method for determination of varenicline in its bulk and tablets. Chem Cent J 2011; 5, doi: 10.1186/1752-153X-5-30
13. Pujeri S. S., Khader A. M. A., Seetharamappa J. Stress degradation studies on varenicline tartrate and development of a validated stability-indicating HPLC method. Sci Pharm 2012; 80, 115–126.
14. Katakam P., Kalakuntla R. P., Sama J. R. A novel stability indicating RP-HPLC assay method for the determination of varenicline in pharmaceutical formulations. Pharmacologia 2012; 3(6), 169–173.
15. Kassem M. G., Attwa M. W., Abdelhameed A. S., Mustafa G. A. E. An isoccratic liquid chromatography-electrospray ionization tandem mass spectrometric determination of varenicline in human plasma and dosage form. Afr J Pharm Pharmacol 2013; 7(20), 1343–1350.
16. Al-Haj A., Alawi M., Arafat T., Hourani M. K. Method development, validation and bioequivalence of varenicline in human plasma by liquid chromatography tandem mass spectrometry. J Chromatogr B 2013; 931, 134–139.
17. Alhazmi H. A., Makeen H. A., El Deeb S. Determination of varenicline by capillary zone electrophoresis. Dig J Nanomater Bios 2013; 8(1), 295–301.
18. Aleksic M. M., Radulovic V., Lijeskic N., Kapetanovic V. Electrochemical response and determination of varenicline at boron doped diamond, glassy carbon and hanging mercury electrodes. Curr Anal Chem 2012; 8(1), 133–142.
19. Kaniansky D., Marák J. On-line coupling of capillary isotachophoresis with capillary zone electrophoresis. J Chromatogr 1990; 498, 191–204.
20. ICH Harmonised Tripartite Guideline: Validation of Analytical Procedures Q2 (R1) Step 4 Version. 2005
Štítky
Farmacie Farmakologie
Článek Nové knihyČlánek Rejstříky
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2013 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Fyziologické faktory ovlivňující osud léčiva v gastrointestinálním traktu
- Cationic Eudragit® Polymers as Excipients for Microparticles Prepared by Solvent Evaporation Method
- Nové knihy
- Vplyv kvartérnej amóniovej soli na liberáciu liečiva s antiseptickým účinkom
- Sledování vzniku hydrátů diklofenaku sodné soli a jejich vlivu na disoluci léčiva z připravených tablet
- K životnímu jubileu doc. RNDr. PhMr. Milana Čeladníka, CSc.
- Alkalimetrické titrácie solí organických zásad v liekopise
- Stanovenie vareniklínu v lieku Champix® dvojdimenzionálnou kapilárnou elektroforézou v spojení s UV detekciou
- Pohľad na poskytovanie starostlivosti v oblasti liekov na Slovensku – lekárnik a pacient
- A chapter from the history of the pharmacy of the Brothers of Mercy in Spišské Podhradí in the 19th and 20th centuries
- 42. sympozium klinické farmacie
- Padesát let seminářů a sympozií z dějin farmacie
- Rejstříky
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pohľad na poskytovanie starostlivosti v oblasti liekov na Slovensku – lekárnik a pacient
- Alkalimetrické titrácie solí organických zásad v liekopise
- Vplyv kvartérnej amóniovej soli na liberáciu liečiva s antiseptickým účinkom
- Fyziologické faktory ovlivňující osud léčiva v gastrointestinálním traktu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



