-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaEADV 2023: Nejnovější výsledky bimekizumabu v léčbě ložiskové psoriázy, psoriatické artritidy a axiální spondylartritidy
27. 3. 2024
Na loňském 32. kongresu Evropské dermatovenerologické akademie (EADV) v Berlíně byla prezentována řada nových výsledků studií s bimekizumabem v několika indikacích. Přinášíme jejich stručný souhrn s vypíchnutím klíčových výsledků.
Indikace a použití bimekizumabu v praxi
Bimekizumab je humanizovaná monoklonální IgG protilátka, která selektivně inhibuje interleukiny IL-17F a IL-17A. Je indikovaný u dospělých pacientů se středně těžkou až těžkou formou ložiskové psoriázy vyžadující systémovou léčbu, s aktivní psoriatickou artritidou (PsA) po selhání ≥ 1 chorobu modifikujícího léčiva a s ankylozující spondylitidou nebo neradiografickou axiální spondylartritidou (nr-axSpA) po selhání konvenční léčby. Doporučená dávka u ložiskové psoriázy činí 320 mg s.c. každé 4 týdny a po 16. týdnu každých 8 týdnů, u aktivní PsA a axSpA 320 mg s.c. každé 4 týdny.
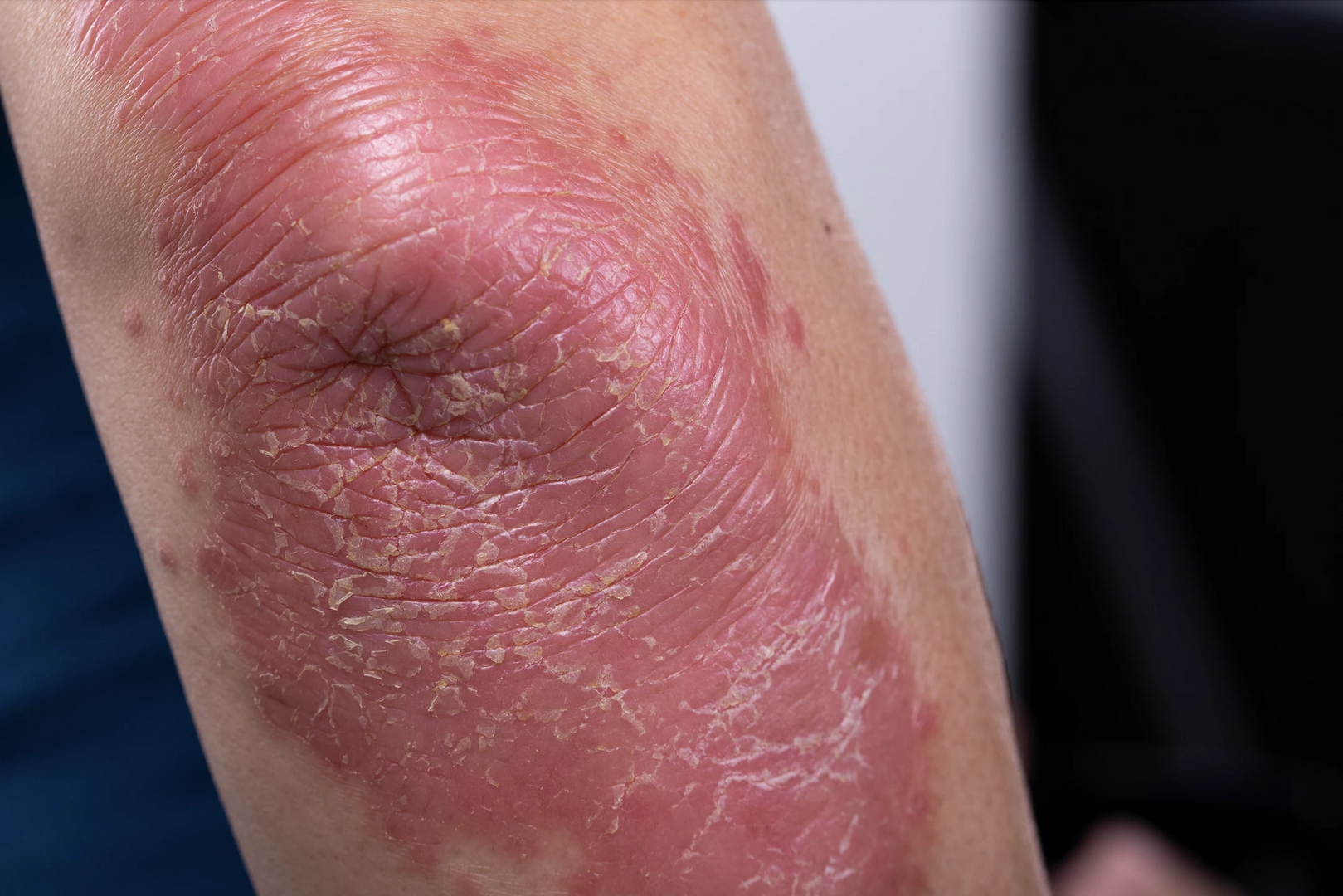
Ložisková psoriáza
Předběžná data ze studie ELEVATE
Multicentrická prospektivní observační studie ELEVATE, jež probíhá ve Francii, Německu, Řecku, Itálii a Spojeném království, hodnotí předchozí léčbu a dopad psoriázy na život dospělých pacientů před zahájením podávání bimekizumabu. Na kongresech EULAR a EADV byly v roce 2023 prezentovány výsledky první předběžné analýzy dat pacientů zařazených v Německu do října 2022. Zahrnovala 196 jedinců, z nichž bylo 126 (64,3 %) léčeno předchozí systémovou léčbou včetně 54 dříve léčených biologickou léčbou, nejčastěji adalimumabem, secukinumabem a ixekizumabem. Z těchto 126 pacientů bylo na bimekizumab převedeno 104 do 12 měsíců od ukončení předchozí léčby včetně 43 převedených z biologické terapie. Bimekizumab byl prvním biologikem u 121 (61,7 %) pacientů.
Ze 175 nemocných se známou předchozí léčbou mělo 64,6 % Index plochy a závažnosti psoriázy (PASI) ≥ 10, 86,9 % mělo zasaženo ≥ 10 % povrchu těla (BSA) a 57,2 % vykázalo skóre Dermatologického indexu kvality života (DLQI) > 10. Před zahájením léčby bimekizumabem bylo průměrné skóre Ukazatele příznaků a dopadu psoriázy (P-SIM) u všech 14 položek > 5 a u položek zarudnutí, šupinatění, suchosti a podráždění kůže ≥ 7. Zhruba 40 % pacientů mělo zasaženu oblast nehtů, 80 % kštici a 33 % dlaně či plosky.
Zdroj: Asadullah K., Korge B., Pinter A. et al. P2594 Treatment history and symptom severity in patients with moderate to severe plaque psoriasis being initiated on bimekizumab: use during the 1st year of routine clinical practice. EADV Congress, Berlin, 2023 Oct 11−14.
Data z německé reálné praxe
V longitudinální observační kohortové studii byla použita data z databáze preskripcí Insight Health, která pokrývá 77 % pojištěnců v Německu. Zařazeno bylo 1002 dospělých, u nichž byla zahájena léčba bimekizumabem od září 2021 do konce roku 2022. Analyzováno bylo období 33 měsíců před nasazením bimekizumabu.
Průměrný věk pacientů činil 48,6 roku, 53,5 % tvořili muži. Bimekizumab nejčastěji předepisovali dermatologové (v 73,1 %) a lékaři v ambulancích nemocnic (25 %). Biologickou léčbu užívalo 33 měsíců před nasazením bimekizumabu 48,5 % pacientů, nejčastěji inhibitory IL-17, IL-23 a tumor nekrotizujícího faktoru alfa (TNF-α). K předchozí změně biologické léčby/apremilastu došlo nejméně 1× u 22,5 % pacientů. Poslední měsíc užívalo nebiologickou systémovou léčbu psoriázy 5,1 % pacientů (apremilast, acitretin, cyklosporin, fumarát, methotrexát, p.o. kortikosteroidy). Pokud se týká komedikace, 12 měsíců před nasazením bimekizumabu užívalo 14,5 % pacientů hypolipidemika, 12,6 % antidepresiva a 10,8 % antidiabetika.
Heterogenita předchozí léčby u pacientů léčených v reálné praxi bimekizumabem ukazuje, že neexistuje jednotný profil pacienta, u něhož je je tato léčba nasazována.
Zdroj: Zink A., Ramond A., Shang A. et al. P2533 Real-world patient characteristics and prior treatment history of bimekizumab patients in Germany. EADV Congress, Berlin, 2023 Oct 11−14.
Účinnost při přerušení a obnovení terapie
V randomizované studii BE READY a jejím otevřeném prodloužení BE BRIGHT bylo hodnoceno přetrvávání klinické odpovědi po vysazení bimekizumabu během 1 roku u pacientů se středně těžkou až těžkou ložiskovou psoriázou. Autoři se snažili zjistit, zda lze odpovědi na tuto léčbu znovu dosáhnout a udržet ji následně po dobu 2 let.
Zařazeni byli pacienti randomizovaní k bimekizumabu, kteří po 16 týdnech dosáhli PASI 90 a byli rerandomizováni k následnému užívání placeba po dobu 40 týdnů. Pokud si udrželi PASI 75 až do 56. týdne, byli převedeni zpět na bimekizumab, který užívali v následném otevřeném hodnocení. Pokud mezi 16. a 56. týdnem došlo k relapsu (PASI < 75), dostali na 12 týdnů bimekizumab. Účastníci s PASI > 50 po této 12týdenní léčbě vstoupili do otevřeného hodnocení bimekizumabu.
K užívání placeba po dosažení PASI 90 s bimekizumabem bylo po 16 týdnech rerandomizováno 105 pacientů. Z nich 31,4 % užívalo celých 40 týdnů placebo, což znamená, že si udrželo PASI ≥ 75, přičemž 51,5 % si udrželo PASI 90 a 33,3 % dosáhlo v 56. týdnu PASI 100. Po obnovení léčby bimekizumabem se odpověď na léčbu výrazně zlepšila a přetrvávala až do 96. týdne. K relapsu (PASI < 75) došlo během podávání placeba u 62,9 % pacientů. Během 12týdenní znovu nasazené léčby bimekizumabem dosáhlo 90,8 % z nich PASI 90 a 63,1 % PASI 100. V 96. týdnu podíl pacientů s PASI 90 přetrvával a podíl s PASI 100 se zvýšil.
Tyto výsledky dokládají přetrvávající odpověď na bimekizumab během 40 týdnů po vysazení u třetiny nemocných, možnost dosažení opakované odpovědi na léčbu při znovunasazení bimekizumabu a jeho následnou účinnost přetrvávající po dobu 2 let.
Zdroj Costanzo A., Papp K., Griffiths C. E. M. et al. P2511 Bimekizumab response through 3 years in patients with plaque psoriasis who stopped and re-started treatment. EADV Congress, Berlin, 2023 Oct 11−14.
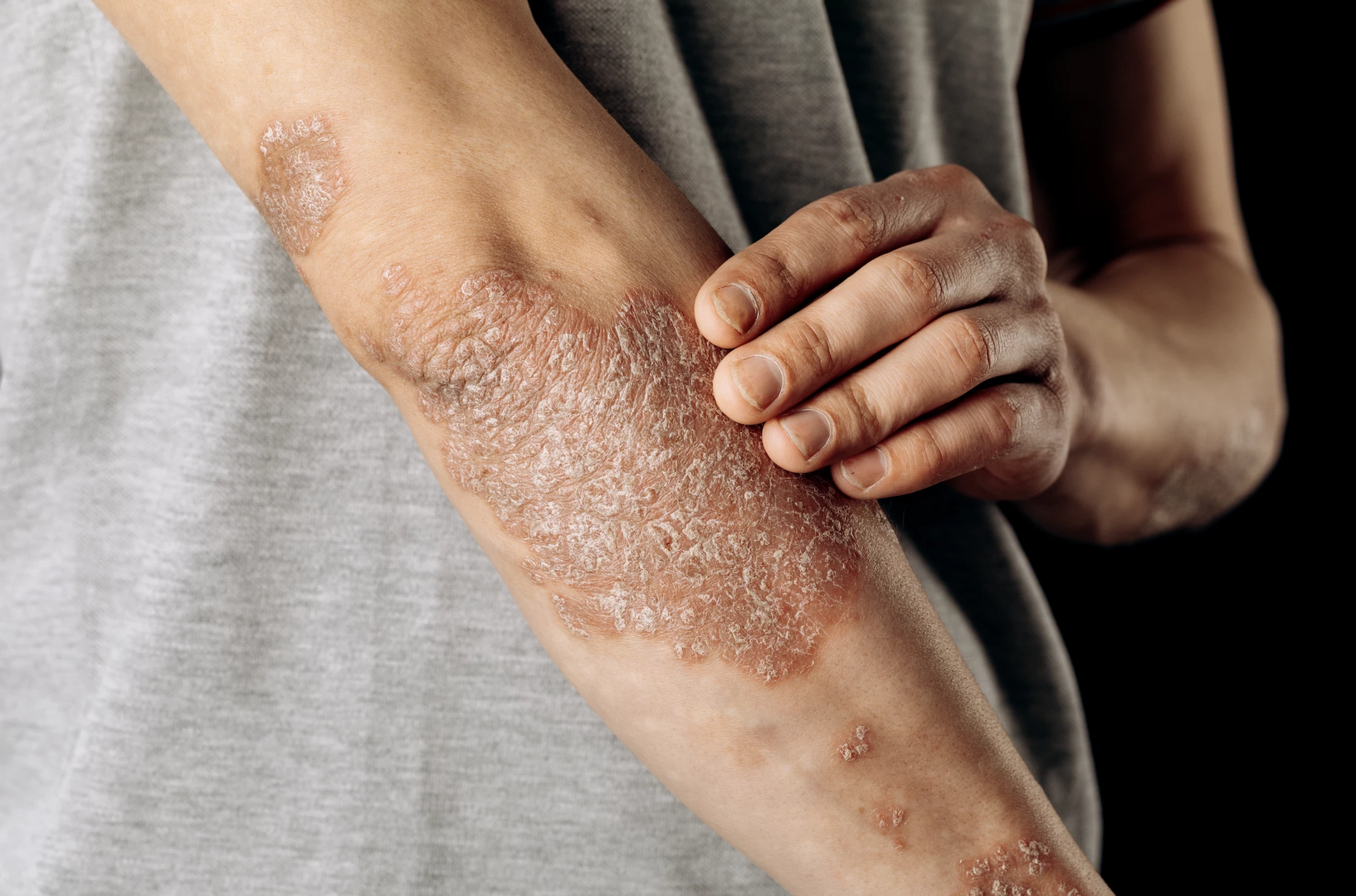
Zmírnění subjektivních příznaků ložiskové psoriázy
Studie BE RADIANT hodnotila vliv bimekizumabu v léčbě středně těžké až těžké ložiskové psoriázy na parametry posuzované samotnými pacienty – svědění, bolest kůže, šupinatění (dle P-SIM) a Dermatologický index kvality života (DLQI) po dobu 3 let. Účastníci byli v této studii randomizováni k podávání bimekizumabu nebo secukinumabu po dobu 48 týdnů a následně v otevřeném prodloužení všichni užívali bimekizumab. Z 336 zařazených užívalo schválený režim dávkování bimekizumabu (320 mg každé 4 týdny a po 16 týdnech každých 8 týdnů) 177 nemocných.
Při léčbě bimekizumabem bylo pozorováno zlepšení P-SIM a DLQI již od 4. týdne. Ve 48. týdnu byl podíl účastníků s absencí svědění, bolesti kůže a šupinatění (P-SIM 0) a DLQI 0/1 numericky vyšší ve skupině s bimekizumabem. Podíl pacientů s P-SOM 0 a DLQI 0/1 přetrval až do 144. týdne včetně podskupiny se schváleným dávkováním. Po převedení ze secukinumabu na bimekizumab se parametry posuzované samotnými pacienty nezměnily nebo se numericky zlepšily a tento stav přetrvával až do 144. týdne.
Zdroj: Gottlieb A. B., Gisondi P., Sator P. et al. P2582 Bimekizumab efficacy through 144 weeks in moderate to severe plaque psoriasis: Patient-reported outcomes from BE RADIANT. EADV Congress, Berlin, 2023 Oct 11−14.
Bezpečnost a tolerabilita dlouhodobé léčby
Sdružená data z 5 studií fáze III s bimekizumabem v léčbě středně těžké až těžké ložiskové psoriázy (BE SURE, BE VIVID, BE READY, BE BRIGHT a BE RADIANT) zahrnující 2186 pacientů reflektují celkovou expozici této léčbě dosahující 5461,4 pacientoroku (PY).
Výsledky ukazují klesající nebo nezvyšující se výskyt nežádoucích příhod s prodlužující se dobou užívání s numericky nižším výskytem při dávkování 1× za 8 týdnů. Nejčastěji se jednalo o nazofaryngitidu (14,1/100 PY), orální kandidózu (10,0/100 PY) a infekce horních dýchacích cest (6,2/100 PY). Incidence orální kandidózy upravená na expozici v čase klesala, žádný případ nebyl těžký a bimekizumab z tohoto důvodu vysadilo jen 1,7 % léčených. Výskyt těžkých infekcí byl nízký (1,3/100 PY), nejčastěji šlo o COVID-19. Nízká byla také incidence zánětlivých střevních onemocnění, srdečních příhod, malignit a neutropenie. Nebyl hlášen žádný případ tuberkulózy.
Zdroj: Lebwohl M., Strober B., Langley R. G. et al. P2315 Bimekizumab 3-year safety and tolerability in moderate to severe plaque psoriasis: long-term pooled analysis from five phase 3/3b trials. EADV Congress, Berlin, 2023 Oct 11−14.
Úplné vymizení psoriázy kštice, dlaní a plosek a nehtů
Sdružená analýza 5 studií fáze III (BE VIVID, BE READY, BE SURE, BE BRIGHT a BE RADIANT) zahrnující 821 jedinců se středně těžkou až těžkou ložiskovou psoriázou léčených bimekizumabem byla zaměřená na postižení kštice a palmoplantární oblasti (skóre IGA či pp-IGA ≥ 3) nebo nehtů (skóre mNAPSI > 10). Sledovaným parametrem byl podíl pacientů, kteří dosáhnou úplného vymizení, tj. nulových hodnot těchto skóre během 3 let léčby bimekizumabem.
Zasažení kštice vymizelo po 16 týdnech u 88 % pacientů a po 3 letech přetrvávala absence tohoto postižení u 83,7 %. Nulového skóre pp-IGA dosáhlo po 16 týdnech 90,6 % pacientů a po 3 letech 91,6 %. Vymizení psoriázy nehtů bylo dosaženo po 16 týdnech u 64,4 % léčených a po 3 letech u 69,5 %. Podíl jedinců s dosažením nulových skóre byl vysoký u udržovací dávky 320 mg 1× za 4 týdny i 1× za 8 týdnů.
Zdroj: Merola J. F., Conrad C., Hampton P. et al. P2547 Bimekizumab 3-year efficacy in high-impact areas in moderate to severe plaque psoriasis: pooled results from five phase 3/3b trials. EADV Congress, Berlin, 2023 Oct 11−14.
Jak dlouho přetrvává terapeutická odpověď?
Data ze stejných 5 studií s bimekizumabem byla společně analyzována u podskupiny pacientů se středně těžkou až těžkou ložiskovou psoriázou, kteří dosáhli po 16 týdnech odpovědi na léčbu definované jako ≥ 90% nebo 100% zlepšení skóre PASI (PASI 90/100) a skóre Celkového hodnocení zkoušejícím (IGA) 0/1. Sledován byl podíl pacientů, kteří si tyto výsledky udrželi do 96. týdne studií.
Z 1362 pacientů dosáhlo po 16 týdnech 86,9 % PASI 90, 62,4 % PASI 100 a 86,9 % IGA 0/1. Po 3 letech přetrvalo PASI 90 u 92,4 % pacientů, kteří vstoupili do otevřeného následného sledování, PASI 100 u 78,0 % a IGA 0/1 u 91,7 %. U pacientů s PASI 100 v 16. týdnu byl také hodnocen dopad psoriázy na kvalitu života podle DLQI. Absence dopadu (DLQI 0/1) přetrvávala po 3 letech u 87,1 % těchto jedinců. Tyto výsledky byly podobné i podskupiny nemocných s udržovacím dávkováním bimekizumabu 1× za 8 týdnů.
Frekvence vysazení léčby z důvodu ztráty účinnosti nebo nežádoucích účinků byla nízká (0,7, resp. 7 %).
Zdroj: Thaçi D., Armstrong A., Gordon K. B. et al. P2540 Bimekizumab 3-year maintenance of response in week 16 responders with moderate to severe plaque psoriasis: results from five phase 3/3b trials. EADV Congress, Berlin, 2023 Oct 11−14.
Rychlý a přetrvávající pokles biomarkerů spojených s KV zánětem
Na kongresu EADV 2023 byly také prezentovány výsledky hodnocení vlivu bimekizumabu na biomarkery kardiovaskulárního (KV) zánětu (C-reaktivní protein /CRP/, poměr neutrofily : leukocyty /NLR/, index triglyceridy : glykémie /TyG/) u pacientů se středně těžkou až těžkou ložiskovou psoriázou ze studií BE VIVID a BE RADIANT v porovnání se secukinumabem, ustekinumabem a placebem.
Při léčbě bimekizumabem došlo po 16 týdnech k významně většímu poklesu NLR v porovnání s placebem a k významnému poklesu CRP v porovnání se vstupem do studie, a to zejména u pacientů s vyšším CRP (≥ 5 mg/dl) při zahájení léčby. Pokles obou těchto biomarkerů přetrvával po celý rok léčby bimekizumabem. Index TyG zůstal od vstupu do studie po celou dobu léčby stabilní. Porovnání s aktivní terapií, které bylo k dispozici, ukázalo podobné trendy u secukinumabu a ustekinumabu.
Zdroj: Warren R. B., Langley R. G., Kokolakis G. et al. P2549 Bimekizumab impact on cardiovascular inflammation markers in moderate to severe plaque psoriasis: results from phase 3 trials. EADV Congress, Berlin, 2023 Oct 11−14.
Psoriatická artritida
Přetrvávající účinnost a bezpečnost bimekizumabu po selhání inhibitorů TNF-α
Dlouhodobá účinnost a bezpečnost bimekizumabu u účastníků studie BE COMPLETE s aktivní psoriatickou artritidou (PsA), kteří dříve vykázali nedostatečnou odpověď nebo intoleranci při podávání inhibitorů TNF-α, byla hodnocena celkem 52 týdnů, a to během 16týdenní dvojitě zaslepené kontrolované fáze a následného otevřeného prodloužení, v jehož rámci byli na bimekizumab převedeni i pacienti původně randomizovaní k podávání placeba.
Výsledky zahrnující 347 účastníků ukázaly přetrvávající účinnost bimekizumabu týkající se stavu kloubů a kůže dle kritérií Americké revmatologické společnosti (ACR) a dle PASI. U pacientů převedených po 16. týdnu z placeba na bimekizumab došlo k významnému zlepšení odpovědi na léčbu. Odpovědi PASI 75 bylo s bimekizumabem dosaženo po 16 týdnech u 82,4 % pacientů, po 52 týdnech u 84,1 % a po převedení z placeba v 52. týdnu u 80,7 %. Přetrvávalo i odeznění entezitidy, daktylitidy, zasažení nehtů a zmírnění disability dle indexu HAQ-DI.
Nežádoucí příhody se do 52. týdne vyskytly u 62,6 % léčených, nejčastěji se jednalo o COVID-19, kandidózu úst, nazofaryngitidu a infekce močových cest. Všechny kandidózy byly lokální a mírné až střední závažnosti, ve 2 případech byly důvodem vysazení léčby. Tento bezpečnostní profil odpovídá předchozím zjištěním.
Zdroj: Coates L. C., Landewé R. B. M., McInnes I. B. et al. PO704 Sustained efficacy and safety of bimekizumab in patients with active psoriatic arthritis and prior inadequate response to tumour necrosis factor inhibitors: results from the phase 3 BE COMPLETE study and its open-label extension up to 1 year. EADV Congress, Berlin, 2023 Oct 11−14.
Přetrvávající účinnost po dobu 1 roku u pacientů s PsA a psoriázou postihující vstupně ≥ 3 % BSA
Post hoc analýza studií BE OPTIMAL a BE COMPLETE hodnotila účinnost a bezpečnost bimekizumabu u 1252 nemocných s psoriatickou artritidou a psoriázou postihující nejméně 3 % tělesného povrchu (BSA).
Výsledky v 52. týdnu ukázaly vysoký podíl pacientů s dosažením ACR50 jak s BSA 3–10 %, tak s BSA ≥ 10 % z obou studií. Podobně byl po 52 týdnech zjištěn maximálně 1 oteklý kloub (SJC ≤ 1) u vysokého podílu pacientů z obou studií a bez ohledu na BSA (3–10 %/> 10 %) při vstupu do studie. Stejně příznivé výsledky byly zaznamenány i z hlediska podílu pacientů s dosažením PASI ≤ 1 a současným dosažením PASI 100 + ACR 50. Bezpečnost bimekizumabu odpovídala předchozím výsledkům.
Zdroj: Thaçi D., Asahina A., Lebwohl M. et al. Bimekizumab efficacy and safety in patients with active psoriatic arthritis and psoriasis: 52-week results from the BE OPTIMAL and BE COMPLETE phase 3 randomised, placebo-controlled studies. EADV Congress, Berlin, 2023 Oct 11−14.
Axiální spondylartritida
Rychlé a výrazné zmírnění subjektivních příznaků včetně bolesti zad a únavy
Výsledky dvou studií fáze III BE MOBILE 1 a 2 s bimekizumabem v léčbě aktivní neradiografické axiální spondylartritidy (nr-axSpA) a radiografické axSpA (r-axSpA, tj. ankylozující spondylitidy) byly hodnoceny v předběžné analýze po 24 týdnech. Zařazeno bylo 254 pacientů s nr-axSpA a 332 s r-axSpA.
Po 16 týdnech bylo s bimekizumabem oproti placebu dosaženo většího podílu pacientů s poklesem skóre celkové i noční bolesti zad a s nejméně 4bodovým poklesem skóre únavy dle FACIT-Fatigue. Po 16 týdnech byl při léčbě bimekizumabem pozorován významně větší pokles celkové i noční bolesti zad, únavy dle FACIT-Fatigue a ranní ztuhlosti dle BASDAI. Rozdíl oproti placebu byl patrný hned od první kontrolní návštěvy. Zlepšení přetrvávalo až do 24 týdne, přičemž pacienti převedení z placeba na bimekizumab po 16týdenní zaslepené fázi ve 24. týdnu dosáhli nebo téměř dosáhli zlepšení pozorovaného u pacientů randomizovaných k užívání bimekizumabu od začátku studie.
Zdroj: Mease P. J., Deodhar A., Dougados M. et al. P0288 Bimekizumab improves key patient-reported symptoms of axial spondyloarthritis including spinal pain and fatigue: results from two phase 3 studies. EADV Congress, Berlin, 2023 Oct 11−14.
(zza)
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Farmacie Farmakologie Farmaceutický asistent
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



