-
Články
Reklama
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ReklamaČrevná mikrobiota: jej vývin a vzťah k vzniku niektorých ochorení
Gut microbiota: its development and relation to certain diseases
Coexistence of humans with microorganisms is well known for a long time. Besides the association with infectious diseases, personal microbiota is important for human health, possibly for some non-infectious diseases. Colonization of the human body with appropriate microorganisms after delivery is essential for physiological immune system maturation and also has an influence on central nervous system development. The composition of the gut microbiota is affected by the mode of delivery, early life nutrition and last but not least by lifestyle and drug, especially antibiotics intake. A comparison of gut microbiomes between individuals living in different parts of the world showed a cardinal variation in its composition and basic enterotypes were defined. Interestingly, it has been found out that the different microbiota species’ composition covers the same, respectively similar metabolic pathways. It is suggested that gut microbiota composition and its dysbiosis may influence civilization diseases development, e. g. diabetes mellitus, obesity, asthma, inflammatory bowel disease, allergy, and autoimmune diseases.
Key words:
gut microbiota • microbiome • health • immune system • dysbiosis
Autoři: Hana Kiňová Sepová; Boris Dudík; Andrea Bilková
Vyšlo v časopise: Čes. slov. Farm., 2017; 66, 267-273
Kategorie: Přehledy a odborná sdělení
Souhrn
Koexistencia ľudí s mikroorganizmami je známa už dávno. Okrem vzťahu s infekčnými chorobami sa v dnešnej dobe potvrdzuje význam personálnej mikrobioty pre zdravie, resp. niektoré neinfekčné choroby človeka. Osídľovanie ľudského tela vhodnými mikroorganizmami po pôrode je esenciálne napr. pre fyziologický vývoj imunitného systému a má vplyv aj na vývoj centrálneho nervového systému. Zloženie črevnej mikrobioty ovplyvňuje najmä spôsob pôrodu, výživa v ranom detstve a v neposlednom rade aj životný štýl a používanie liekov, najmä antibiotík. Porovnaním črevného mikrobiómu ľudí z rôznych častí sveta sa našli zásadné rozdiely v jeho zložení na základe čoho boli definované konkrétne enterotypy. Zaujímavé bolo zistenie, že druhovo rôzne zloženie mikrobioty pokrýva tie isté, resp. podobné metabolické dráhy. Ukazuje sa, že práve črevná mikrobiota a jej dysbióza môže mať za následok vznik rôznych tzv. civilizačných ochorení, ako napr. diabetes mellitus, obezita, astma, zápalové ochorenia čreva, alergie a autoimunitné ochorenia.
Kľúčové slová:
črevná mikrobiota • mikrobióm • zdravie • imunitný systém • dysbiózaÚvod
Ľudské telo obýva veľký počet komenzálnych, symbiotických, ale aj patogénnych mikrorganizmov, z ktorých najväčšiu skupinu tvoria baktérie. Nachádzame tu taktiež zástupcov z radov húb, vírusov, Protozoa a Archea. Spoločenstvo všetkých mikroorganizmov v ľudskom tele nazývame ľudská mikrobiota a z pohľadu molekulárnej biológie je súbor všetkých mikrobiálnych génov v ľudskom tele ľudský mikrobióm. V súčasnej dobe už vieme o význame a dôležitosti prirodzenej mikrobioty pre zdravie človeka, zloženie a funkčná charakteristika zdravého mikrobiómu však neboli doposiaľ presne definované1).
Za účelom charakterizovať ľudskú mikrobiotu a rozšíriť naše poznatky o tom, ako mikrobióm ovplyvňuje ľudské zdravie a chorobu, vznikol Projekt ľudského mikrobiómu (Human Microbiome Project). V rámci štúdie boli charakterizované mikrobiálne komunity zdravých jedincov v rôznych častiach tela: v ústnej dutine, nazálnych dutinách, gastroinstestinálnom trakte, urogenitálnom trakte a na pokožke. Všetky výsledky tohto projektu sú voľne dostupné na oficiálnej webovej stránke (https://hmpdacc.org/hmp/overview/)2).
V posledných rokoch sa štúdium ľudského mikrobiómu zameriava predovšetkým na črevo, ktorého mikrobiálne zloženie pravdepodobne ovplyvňuje vývoj a správne fungovanie imunitného systému. Narušenie črevnej mikrobioty – dysbióza – je takisto asociovaná so vznikom, respektíve priebehom rôznych ochorení, ako sú napr. zápalové ochorenia čreva (IBD) alebo niektoré metabolické ochorenia3). Zaujímavé sú tiež štúdie naznačujúce prepojenie črevnej mikrobioty s osou črevo – mozog, toto prepojenie by sa mohlo podieľať na vývoji centrálneho nervového systému, ako aj na niektorých prejavoch správania4).
V predkladanom prehľadovom článku sa zameriame na baktérie črevnej mikrobioty, keďže tieto tvoria majoritnú časť mikrobiálnej populácie v tejto časti ľudského tela, popri vírusoch, hubách, archeónoch a protozoách.
Zloženie črevnej mikrobioty a jej zmeny v priebehu života
Črevo poskytuje útočisko viac ako 100 triliónom mikroorganizmov a tým tvorí jeden z najkomplexnejších a najbohatších ekosystémov ľudského tela5). Táto črevná populácia exprimuje cca 3,3 miliónov bakteriálnych génov, zatiaľ čo ľudský genóm iba približne 20 0006). Veľké interpersonálne rozdiely v zložení črevnej mikrobioty naznačujú, že pôvodná myšlienka „základnej“ populácie mikroorganizmov, ktorá by bola univerzálna pre všetkých ľudí, nie je úplne správna. Na druhej strane sa zistilo, že existuje súbor mikrobiálnych génov, ktoré sa vyskytujú u takmer všetkých ľudí7, 8). Preto sa zdá, že hoci existuje interindividuálne kolísanie v zložení bakteriálnych komunít, zastúpenie konkrétnych metabolických dráh je pomerne konzervované9). Črevnú mikrobiotu teda môžeme chápať ako virtuálny orgán, ktorý zabezpečuje rôzne funkcie dôležité pre správne fungovanie hostiteľa.
Ako sa meníme vekom my, tak sa mení aj naša mikrobiota. U dospelých jedincov nachádzame v čreve dvoch hlavných zástupcov bakteriálnych kmeňov (Phylum): gramnegatívne Bacteroidetes a grampozitívne Firmicutes. V menšom počte sú to kmene Actinobacteria, Fusobacteria a Verrucomicrobia, ktorých zastúpenie sa významne mení medzi jednotlivcami10–12). Na základe sekvenovania 16S rDNA črevnej mikrobioty Arumugam a kol.11) rozdelili jedincov pochádzajúcich zo šiestich krajín do tzv. enterotypov podľa dominujúceho bakteriálneho rodu: enterotyp I je obohatený o Bacteroides (primárne získavajú energiu zo sacharidov a proteínov pomocou fermentácie), enterotyp II o Prevotella spolu s Desulfovibrio a enterotyp III o Ruminococcus spolu s Akkermansia (ostatné dva degradujú najmä glykoproteíny mucínu v čreve). Autori nepozorovali signifikantné spojenie medzi enterotypom a charakteristikami hostiteľa (národnosť, pohlavie, vek, BMI). Napríklad pohlavie hostiteľa nepredpovedá určitý enterotyp, ale predikuje určitú funkciu mikrobiómu (napr. zvýšená prítomnosť bakteriálnych génov zapojených do biosyntézy aspartátu u mužov)13). Wu a kol.14) preukázali, že dlhodobý spôsob stravovania má vplyv na zloženie črevnej mikrobioty a pozorovali dva rozdielne enterotypy: prvý u jedincov, u ktorých majoritnú časť stravy tvorili proteíny a živočíšne tuky a dominoval u nich rod Bacteroides, a druhý, kde v strave dominovali sacharidy a baktérie rodu Prevotella. Tretí slabšie rozlíšiteľný enterotyp, ktorý definovali Arumugam a kol.11) bol priradený k enterotypu Bacteroides. Na vyššej fylogenetickej úrovni pozorovali Wu a kol.14) asociáciu Bacteroidetes a Actinobacteria so stravou bohatou na tuky, ale chudobnou na vlákninu a naopak, Firmicutes a Proteobacteria boli spojené so stravou bohatou na vlákninu, ale chudobnou na tuky. Zaujímavé bolo tiež zistenie, že krátkodobá (10 dní) zmena stravy mala síce už po 24 h pozorovateľný vplyv na zloženie mikrobiómu, ale k zmene enterotypu neprišlo14). Ďalšie výskumy tiež potvrdzujú, že väčšina bakteriálnych kmeňov našej individuálnej mikrobioty pretrváva v čreve roky, čo naznačuje, že kolonizátori čreva majú potenciál meniť viaceré aspekty našich biologických znakov po väčšinu, ak nie po celý náš život15). Otázkou ostáva, či by dlhodobá zmena stravovania ovplyvnila aj zmenu enterotypu a či práve enterotyp môžeme asociovať s konkrétnymi chorobami.
Relatívne stabilnému mikrobiálnemu osídleniu čreva u dospelých predchádza vývin v ranom detstve, ktorý významne ovplyvňujú viaceré faktory. Tráviaci trakt novorodenca je tradične považovaný za sterilný, aj keď v plodovej vode boli v malom počte i druhovej diverzite detegované baktérie16) a DNA zástupcov rodov Lactobacillus a Bifidobacterium17). Dokonca aj placenta má svoj unikátny mikrobióm, ktorý sa u zdravej placenty v termíne pôrodu zložením podobá orálnemu mikrobiómu18). Významnú úlohu v mikrobiálnej kolonizácii čreva má spôsob pôrodu. Prechodom pôrodnými cestami dieťa získava vaginálnu mikrobiotu matky a jeho tráviaci trakt osídľujú zástupcovia rodov Lactobacillus, Prevotella a Sneathia. Na druhej strane, deti narodené cisárskym rezom majú prvotnú mikrobiotu tvorenú baktériami rodov Staphylococcus, Corynebacterium a Propionibacterium, ktorá je podobná bakteriálnym komunitám osídľujúcich pokožku13). Fekálna mikrobiota týchto jedincov obsahuje nižší počet baktérií a vyšší počet imunitných buniek produkujúcich protilátky19). Chýbanie expozície matkiným vaginálnym baktériám môže vysvetľovať väčší výskyt juvenilného diabetu, celiakie, astmy a obezity u jedincov narodených sekciou20, 21). Táto prvotná mikrobiota pretrváva v tráviacom trakte v 1. roku života22). Až do veku 2 rokov je fekálna mikrobiota dieťaťa charakterizovaná ako stochastický systém, resp. proces, ktorý smeruje k vyváženému stavu dospelých jedincov.
Ďalším významným faktorom, ktorý ovplyvňuje zloženie črevnej mikrobioty hneď po pôrode, je spôsob výživy dieťaťa. Dojčenie uprednostňuje rast určitých druhov spomedzi iniciálnej mikrobioty, ktorá sa mohla v čreve vyskytnúť náhodne23). Oligosacharidy obsiahnuté v materskom mlieku slúžia ako výhradný zdroj uhlíka pre malý počet baktérií rodov Bifidobacterium a Bacteroides24). Naproti tomu, oligosacharidy kravského mlieka, obsiahnuté v umelých dojčenských mliekach, podporujú rast a metabolizmus mikrobioty podobnej zvieracím mláďatám25). Na základe uvedených skutočností je možné usudzovať, že jedným z dlhodobých prínosov dojčenia je aj správna modulácia zloženia mikrobiómu23). Metagenómová analýza ukázala, že v ranom štádiu života, keď dieťa konzumuje výhradne mlieko, materské, alebo umelé, je mikrobióm obohatený o gény napomáhajúce utilizácii laktózy26). Zaujímavé je tiež zistenie, že funkčnú schopnosť využívať glykány z rastlinnej stravy má dieťa ešte pred zavádzaním nemliečnych príkrmov do jedálnička. To naznačuje, že dieťa je pripravené prijímať inú ako mliečnu stravu ešte predtým, ako sa táto zmena udeje26). Črevný mikrobióm dojčiat je obohatený aj o gény zapojené do biosyntézy folátu de novo, kým u dospelých jedincov sú viac zastúpené gény, ktoré sa podieľajú na metabolizácii folátu a jeho redukovanej formy, tetrahydrofolátu zo stravy. Vekom postupne ubúdajú súčasti de novo biosyntetických ciest folátu, a naopak pribúdajú gény kódujúce enzýmy podieľajúce sa na biosyntéze kobalamínu. Rozdiel v schopnosti biosyntézy kobalamínu u dojčiat a dospelých korelujú s nízkym, resp. vysokým zastúpením Bacteroidetes, Firmicutes a Archea v mikrobiote. U dojčiat dominujú baktérie rodov Bifidobacterium, Lactobacillus, Lactococcus a Streptococcus, ktoré spomínanými génmi nedisponujú27). Zmeny v prítomnosti/neprítomnosti biosyntetických ciest v mikrobióme korelujú tiež s poklesom krvných hladín folátu a nárastom kobalamínu v závislosti od veku28).
Proces starnutia je vo všeobecnosti spojený so zhoršením fyziologických funkcií organizmu a úbytkom a znížením stability prospešnej črevnej mikrobioty. Zloženie črevnej mikrobioty starších ľudí je výrazne odlišné od mikrobioty mladších dospelých a vyznačuje sa zníženými počtami baktérií kmeňa Firmicutes a celkovo nižšou diverzitou29). Mikrobiota starších je tiež asociovaná s vyšším výskytom Bacteroidetes a znížením Clostridium zoskupenia IV30). A práve znížená diverzita črevnej mikrobioty je spojená s vyšším rizikom vzniku ochorení, ako sú IBD, diabetes mellitus, obezita, syndróm dráždivého čreva (IBS) a i. Claesson a kol.31) zistili priamy súvis medzi spôsobom stravovania, zložením mikrobioty a zdravotným stavom u starších ľudí, čo naznačuje možnosť modulovať črevnú mikrobiotu úpravou diéty, prípadne podávaním vhodných probiotík a prebiotík.
Vplyv črevnej mikrobioty na vývin imunitného systému
Zloženie ranej mikrobioty má vplyv aj na správny vývoj a maturáciu imunitného systému. Udomácnenie prospešných rodov baktérií v raných štádiách života podporuje navodenie imunotolerancie a môže znížiť riziko, alebo zamedziť vzniku autoimunitných ochorení32–34). Vrodená imunitná odpoveď predstavuje prvú líniu obrany pred inváziou patogénov. Táto odpoveď je spustená cez aktiváciu receptorov rozpoznávajúcich vzory (Pattern Recognition Receptors – PRRs), ktoré predstavujú kľúčové spojenie medzi rozpoznaním patogénu a spustením prozápalovej kaskády, ktorá vedie k potlačeniu infekčného agens35). Intestinálne epitelové bunky (Intestinal Epithelial Cells – IECs) exprimujú rôzne PRRs, ktoré sprostredkúvajú interakcie medzi imunitným systémom a komenzálnou mikrobiotou36). Medzi PRRs patria napr. TLRs (Toll-like Receptors, receptory podobné Toll), či NLRs (Nuclear Oligomerization domain-like receptor, receptory podobné nukleárnej oligomerizačnej doméne), ktoré rozpoznávajú MAMPs (Microorganism-Associated Molecular Patterns, molekulové vzory asociované s mikroorganizmami). Po naviazaní určitého MAMP dochádza k spusteniu vnútrobunkovej signálnej kaskády, ktorá vedie k aktivácii/inhibícii expresie pro - alebo protizápalových mediátorov. Cieľom je navodenie imunitnej homeostázy makroorganizmu37).
Ak nie sú TLRs prítomné, alebo sú patologicky zmenené, črevo a slizničný imunitný systém sa nevyvíja fyziologicky38). Práve komenzálne baktérie sa javia ako dôležité v potlačení zápalovej odpovede a navodení imunologickej tolerancie; táto interakcia sa deje aj cez TLRs38, 33). Na interakcii MAMP-PRR sa zúčastňujú viaceré typy štruktúr mikroorganizmu a hostiteľského makroorganizmu. Bakteriálne MAMP sú prevažne makromolekuly, ktoré sa nachádzajú na povrchu buniek. Hoci majú podobnú základnú štruktúru, existujú medzi nimi nepatrné rozdiely. Variácie MAMP vedú k rozdielnej interakcii s PRR a potenciálnymi koreceptormi39), čo sa môže prejaviť tak, že makromolekula jedného bakteriálneho druhu je pre určitý PRR agonistom, kým podobná makromolekula iného druhu jeho antagonistom40). Príkladmi MAMP sú lipopolysacharidy, lipid A, peptidoglykány, proteínové štruktúry bičíkov a mikrobiálna RNA/DNA. Zo strany hostiteľa sú za kontrolu rastu mikrobiálnych komunít zodpovedné aj tzv. antimikróbne peptidy (AMP), ktoré patria k jedným z fylogeneticky najstarších zložiek vrodenej imunitnej odpovede reagujúcich na bakteriálne infekcie41, 42). Medzi AMP, ktoré sú v prípade bakteriálnej kolonizácie „up-regulované“, patria napr. α a β defenzíny a katelidicíny. Rovnováha medzi imunitným systémom a imunoregulačnými funkciami baktérií sa javí ako veľmi krehká a strata jedného špecifického druhu môže viesť k vývoju prehnanej, alebo naopak k obmedzenej vrodenej imunitnej odpovedi43–46).
V prípade, že sa zloženie mikrobiálnej komunity formuje z veľkej meta-populácie potenciálnych kolonizátorov na základe toho, aby jej členovia pokryli kľúčovú množinu funkcii, je pravdepodobné, že budú ekologicky rôznorodí47–49). A to čo sa týka počtu taxónov, aj počtu ich zástupcov23). Vo všeobecnosti je vysoká diverzita mikroorganizmov spojená so zdravím hostiteľa50) a dočasnou mikrobiálnou stabilitou51). S predĺžením ľudského života a zlepšením jeho kvality v rozvinutých krajinách sa zvýšil výskyt ochorení bez zjavnej príčiny. Vysvetlenie by mohla poskytnú teória „miznúceho mikrobiómu“ 52), ktorá ide ruka v ruke s dobre známou tzv. hygienickou hypotézou: zvýšená hygiena a znížený kontakt s parazitmi a patogénmi v skorých štádiách života, spolu s neuváženým používaním antibiotík a dezinfekčných prostriedkov, môžu byť zodpovedné za zvýšený výskyt alergii a autoimunitných ochorení53, 54). Získaná imunitná odpoveď je teda do určitej miery ovplyvniteľná prítomnosťou mikroorganizmov. Diferenciácia naivných CD4 T buniek je vysoko regulovaný proces, ktorý zahŕňa formáciu štyroch podtried, ktoré sú každá charakteristická produkciou špecifických cytokínov: TH1 (IFN-γ, TNF-α), TH2 (IL-4, IL-5, IL-13), TH17 (IL-17, IL-21, IL-22) a TREG (IL-10). Odpoveď sprostredkovaná TH17 bunkami hrá dôležitú úlohu v rovnováhe medzi pro - a protizápalovou reakciou. Ich primárnou úlohou je obmedzenie TREG buniek pri supresii TH1 odpovede55). A práve prítomnosť špecifických mikroorganizmov môže determinovať, ktoré podtriedy T pomocných buniek budú dominovať v tkanivách gastrointestinálneho traktu, a teda či bude v čreve prevládať pro - alebo protizápalové prostredie56, 57). Nižšia expozícia mikroorganizmami po narodení posúva rovnováhu medzi TH1 a TH2 lymfocytmi v prospech TH2, ktoré sú zodpovedné za vznik alergických ochorení. Hygienická hypotéza by bola úplne platná, keby vo vyspelom svete nevzrastali nielen alergie, ale aj autoimunitné ochorenia, ktoré sú zväčša podmienené TH1 typom imunitnej odpovede. Tu by vysvetlenie mohla poskytnúť vyššie spomenutá teória „miznúceho mikrobiómu“, ktorá predpokladá, že výskyt civilizačných ochorení (napr. gastroezofageálny reflux a rakovina pažeráku, astma, atopická dermatitída, metabolický syndróm, diabetes mellitus typu II, obezita, IBD) je dôsledok straty starobylých mikroorganizmov, ktoré sme po generácie získavali od predkov58). Ak sa tieto stratili v jednej generácii, ďalšie ich nemali ako nadobudnúť. Zmena spôsobu života a ekologických podmienok môže meniť aj zloženie ľudskej mikrobioty. Čistá voda, pribúdanie pôrodov cisárskym rezom, indikácia antibiotík pred pôrodom, obmedzenie dojčenia a rodiny s menším počtom členov sú zodpovedné za redukovaný prenos mikrobioty. Rozsiahle používanie antibiotík, zvýšená hygiena a používanie amalgámových zubných plomb sú ďalšími faktormi, ktoré „napomáhajú“ zmenám v zložení mikrobioty. Blaser a Falkow58) sa domnievajú, že zmeny v ľudskej makroekológii postupne ovplyvňujú zloženie našej pôvodnej mikrobioty, ktorá následne ovplyvňuje našu fyziológiu a nakoniec aj riziko rôznych chorôb.
Dysbióza
Zdravý ľudský mikrobióm charakterizuje vysoká diverzita a relatívna stabilita, kým redukcia rozmanitosti sa zdá byť spojená s dysbiózou. Z ekologického pohľadu stabilita predstavuje funkčnú vlastnosť zdravia danej komunity. Táto stabilita hovorí o schopnosti komunity odolať zmenám v prostredí ekologických výkyvov (rezistencia), alebo sa vrátiť do stavu rovnováhy, ktorá nasleduje po narušení stresom (pružnosť)1). Dysbióza je dôsledok nerovnováhy v zložení mikrobiómu, ktorej výsledkom je zmenený pomer komenzálnych a patogénnych baktérií6).
Jedným z vonkajších faktorov podieľajúcich sa na vzniku dysbiózy je užívanie antibiotík. Okrem toho, že nadmerná spotreba antibiotík je spojená s nárastom rezistentných kmeňov patogénnych baktérií, spôsobuje aj zásadnú redukciu diverzity v mikrobióme59). Obnovenie predchádzajúcej komunity je vysoko variabilné a potenciálne je oslabená aj jej schopnosť eliminovať patogény23). Len päť dňové užívanie ciprofloxacínu viedlo k prudkému poklesu početnosti bakteriálnych taxónov, ktoré sa prejavilo znížením početnosti, diverzity a rozloženia v komunite. Napriek rovnakej terapii sa medzi jedincami zahrnutými v štúdii vyskytovali zmeny v zložení črevnej mikrobioty. Štyri týždne po ukončení užívania ciprofloxacínu sa stav mikrobioty u väčšiny jedincov vrátil do stavu podobnému pôvodnému, ale u niektorých jednotlivcov sa mikrobióm nezotavil ani po 6 mesiacoch59). Z dlhodobého hľadiska teda antibiotiká spôsobujú zníženie bakteriálnej diverzity. Ak sa aj bakteriálna komunita zotaví po antibiotickej terapii, stále zostáva prítomná znížená schopnosť odolávať kolonizácii cudzími baktériami, ktoré prerastú komenzálnu mikrobiotu a spôsobujú permanentné zmeny v štruktúre mikrobiómu44).
Viaceré štúdie poukazujú na priame spojenie medzi dysbiózou a zápalovými a metabolickými ochoreniami, ako napr. IBD, obezita a rakovina44–46) (tab. 1). Ťažko možno určiť, ktorý posun v zložení črevnej mikrobioty vedie k ochoreniu, lebo dnešné poznatky nám nepostačujú na to, aby sme vedeli, či dysbióza je príčinou, alebo následkom týchto ochorení1). Ukazuje sa napr., že redukcia druhov z Firmicutes a Bacteroidetes a rozšírenie Proteobacteria stojí za vyvolaním niektorých foriem IBD. Výskyt protektívnej komenzálnej baktérie s protizápalovými vlastnosťami Faecalibacterium prausnitzii (Firmicutes) je často znížený práve u pacientov s Crohnovou chorobou (jedna z foriem IBD)60, 45). U pacientov trpiacich IBD, ktorí majú oslabenú bariérovú funkciu čreva, je päťkrát vyššie riziko vzniku rakoviny čreva v dôsledku zápalovej reakcie na komenzálnu mikrobiotu oproti zdravým jedincom61)
Tab. 1. Predpokladaný mechanizmus, akým sa dysbióza podieľa na patogenéze niektorých ochorení 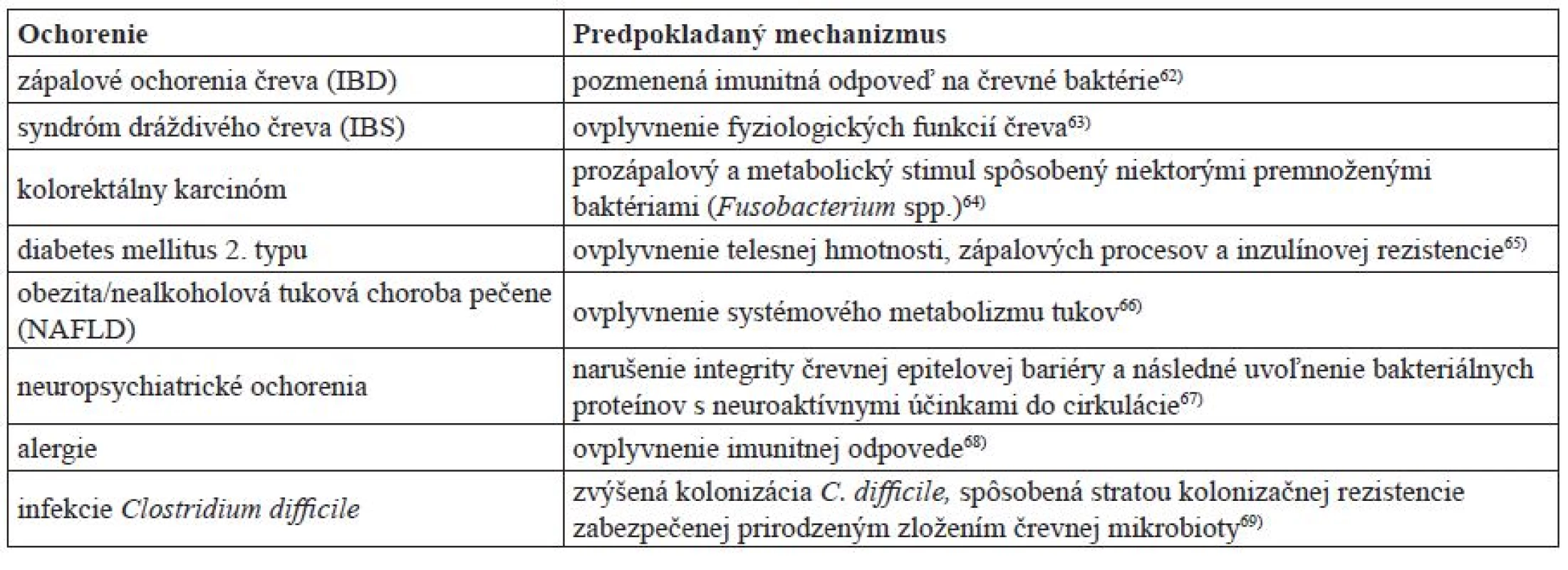
Os črevná mikrobiota – črevo – mozog
Zaujímavé je aj spojenie medzi črevom a mozgom. V ostatných rokoch začala byť črevná mikrobiota považovaná za endokrinných orgán, pretože je schopná produkovať látky reagujúce so špecifickými receptormi70). Bolo dokázané, že látky, ktoré produkuje črevná mikrobiota, sú schopné ovplyvniť aj v relatívne nízkych koncentráciách vzdialené orgány, ako napríklad mozog. Okrem mastných kyselín s krátkym reťazcom (Short Chain Fatty Acids – SCFA), metabolitov tryptofánu a žlčových kyselín, dokáže mikrobiota produkovať aj neurotransmitery, vrátane serotonínu, dopamínu, noradreanlínu a tryptofánu. Z týchto dôvodov sa niekedy črevná mikrobiota nazýva aj „druhý mozog“ 71). Rôzne mikrobiálne metabolity sú schopné ovplyvniť produkciu serotonínu a týmto spôsobom rozširujú spojenie medzi črevom a mozgom na os mikrobiota-črevo-mozog (microbiota-gut-brain axis)55). Os mikrobiota-črevo-mozog teda reprezentuje komplexnú komunikačnú sieť medzi črevom, črevnou mikrobiotou a mozgom a mení funkcie imunitného, gastrointestinálneho a centrálneho nervového systému72, 73). Rosenfeld74) poukázala na vplyv mikrobiálnych metabolitov, ako sú 4-etylfenylsulfát, SCFA a amoniak, ktoré môžu mať negatívny neurobehaviorálny efekt. Autorka načrtla problematiku spojenia mikrobioty, čreva a mozgu a formulovala hypotézu, či črevná dysbióza a aberantný črevný metabolizmus môžu viesť k poškodeniam podobným autizmu.
Vývoj mozgu je počas prenatálneho života citlivý na interné a externé signály z prostredia (obr. 1). Výživa, infekcie, stres matky počas tehotenstva sú spojené s vývojovými poruchami nervového systému, ako sú autizmus, porucha pozornosti spojená s hyperreaktivitou (Attention Deficit Hyperreactivity Disorder – ADHD) a schizofrénia75–78). Zdravie matky hrá kľúčovú úlohu v správnom vývine mikrobioty a nervového systému dieťaťa79). Vo vývoji intervencií modulujúcich zloženie mikrobioty je dôležité charakterizovať aj zloženie mikrobioty počas tehotenstva, lebo má vplyv na vývoj mikrobioty a potenciálne aj vývoj mozgu novorodenca80).
Obr. 1. Vplyvy na os mikrobiota-črevo-mozog v perinatálnom období. Viaceré faktory ovplyvňujúce črevnú mikrobiotu matky môžu ovplyvniť vývoj mozgu in utero cez mikrobiálne metabolity, metabolity liečiv a zápalové zmeny. Postnatálne je črevná mikrobiota silno ovplyvnená spôsobom pôrodu a výživy (podľa Mayer a kol.<sup>4)</sup>) 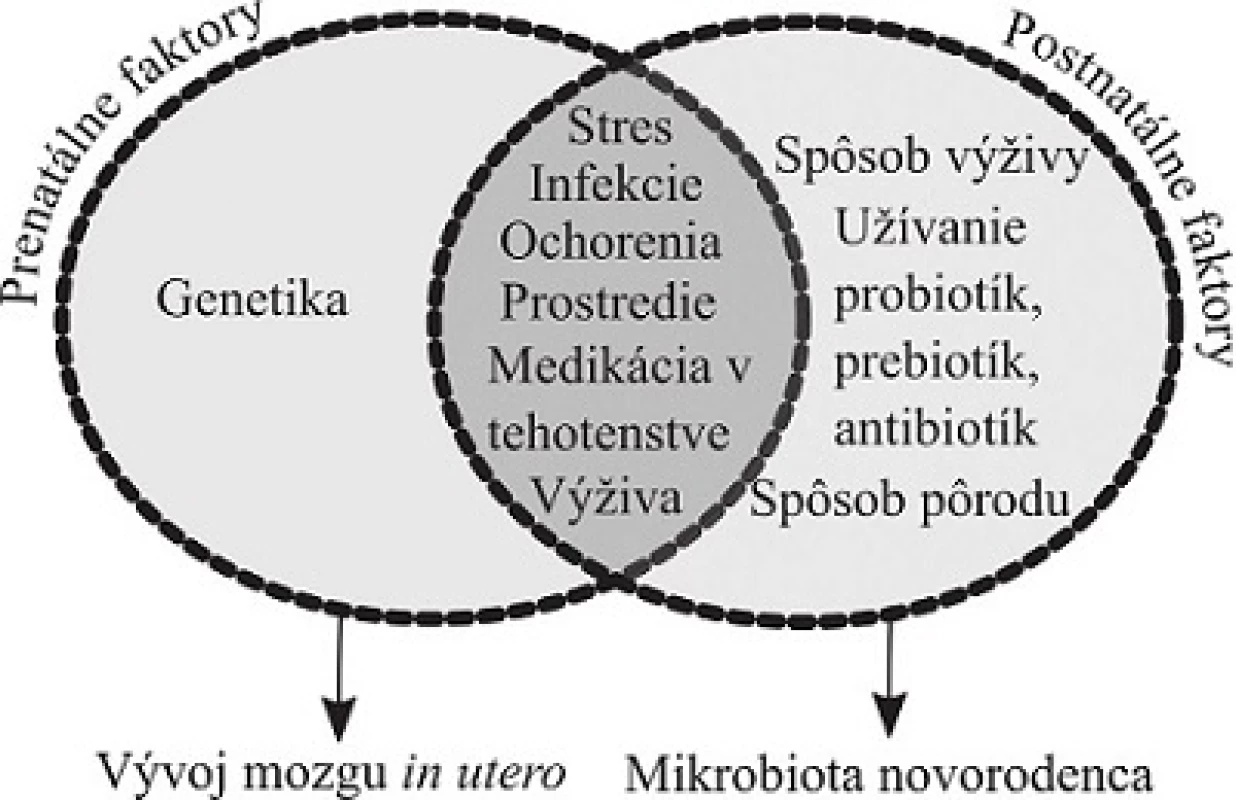
Záver
Črevný mikrobióm je komplexný a dynamický ekosystém, ktorý dokáže ovplyvniť fungovanie hostiteľského makroorganizmu a jeho zdravie a choroby. Z hľadiska množstva génov, ktorými črevný mikrobióm disponuje, a obohacuje tak genóm hostiteľa, by sme ho nemali brať na „ľahkú váhu“. Perspektívnou stratégiou v oblasti profylaxie a terapie niektorých ochorení sa ukazuje cesta modulácie dysbiotickej mikrobioty v prospech jej prirodzeného zloženia. Existujú viaceré spôsoby ako modulovať zloženie a funkciu črevnej mikrobioty, najefektívnejšími sa javia užívanie probiotík, prebiotík a v ostatnej dobe aj tzv. transplantácia fekálnej mikrobioty81). Otázkou ostáva, či tento biologický systém (virtuálny orgán) budeme vedieť modifikovať v prospech hostiteľa, a tak mu prinavrátiť zdravie.
Stret záujmov: žiadny.
Došlo 9 novembra 2017
Prijato 27 novembra 2017
PharmDr. Hana Kiňová Sepová, PhD.
B. Dudík
A. Bilková
Katedra bunkovej a molekulárnej biológie liečiv
Farmaceutická fakulta, Univerzita Komenského v Bratislave
Kalinčiakova 8, 832 32 Bratislava, SR
e-mail: kinovasepova@fpharm.uniba.sk
Zdroje
1. Bäckhed F., Frase C. M., Rigel Y., Sanders M. E., Sartor R. B., Sherman P. M., Versalovic J., Young V., Finlay B. B. Defining a healthy human gut microbiome: current concepts, future directions, and clinical applications. Cell Host Microbe 2012; 12, 611–622.
2. NIH Human Microbiome Project. https://hmpdacc.org/hmp/overview/ (6. 11. 2017).
3. Jandhyala S. M., Talukdar, R., Subramanyam, C., Vuyyuru H., Sasikala M., Nageshwar Reddy D. Role of the normal gut microbiota. World J. Gastroenterol. 2015; 21, 8787–8803.
4. Mayer E. A., Tillisch K., Gupta A. Gut/brain axis and the microbiota. J. Clin. Invest. 2015; 125, 926–938.
5. Human Microbiome Project Consortium. A framework for human microbiome research. Nature 2012; 486, 215–221.
6. Belizário J. E., Napolitano M. Human microbiomes and their roles in dysbiosis, common disease, and novel therapeutic approaches. Front. Microbiol. 2015; 6 : 1050.
7. Turnbaugh P. J., Hamady M., Yatsunenko T., Cantarel B. L., Duncan A., Ley R. E., Sogin M. L., Jones W. J., Roe B. A., Affourtit J. P., Egholm M., Henrissat B., Heath A. C., Knight R., Gordon J. I. A core gut microbiome in obese and lean twins. Nature 2009; 457, 480–484.
8. Turnbaugh P. J., Gordon J. I. The core gut microbiome, energy balance and obesity. J. Physiol. 2009; 587, 4153–4158.
9. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human. Nature 2013; 486 : 207–2014.
10. Zoetendal E. G., Rajilic-Stojanovic M., de Vos W. M. High-throughput diversity and functionality analysis of the gastrointestinal tract microbiota. Gut 2008; 57, 1605–1615.
11. Arumugam M., Raes J., Pelletier E., Le Paslier D., Yamada T., Mende D. R., Fernandes G. R., Tap J., Bruls T., Batto J. M., Bertalan M., Borruel N., Casellas F., Fernandez L., Gautier L., Hansen T., Hattori M., Hayashi T., Kleerebezem M., Kurokawa K., Leclerc M., Levenez F., Manichanh C., Nielsen H. B., Nielsen T., Pons N., Poulain J., Qin J., Sicheritz-Ponten T., Tims S., Torrents D., Ugarte E., Zoetendal E. G., Wang J., Guarner F., Pedersen O., de Vos W. M., Brunak S., Doré J., MetaHIT Consortium, Antolín M., Artiguenave F., Blottiere H. M., Almeida M., Brechot C., Cara C., Chervaux C., Cultrone A., Delorme C., Denariaz G., Dervyn R., Foerstner K. U., Friss C., van de Guchte M., Guedon E., Haimet F., Huber W., van Hylckama-Vlieg J., Jamet A., Juste C., Kaci G., Knol J., Lakhdari O., Layec S., Le Roux K., Maguin E., Mérieux A., Melo Minardi R., M‘rini C., Muller J., Oozeer R., Parkhill J., Renault P., Rescigno M., Sanchez N., Sunagawa S., Torrejon A., Turner K., Vandemeulebrouck G., Varela E., Winogradsky Y., Zeller G., Weissenbach J., Ehrlich S. D., Bork P. Enterotypes of the human gut microbiome. Nature 2011; 473, 174–180.
12. Segata N., Haake S. K., Mannon P., Lemon K. P., Waldron L., Gevers D., Huttenhower C., Izard J. Composition of the adult digestive tract bacterial microbiome based on seven mouth surfaces, tonsils, throat and stool samples. Genome Biol. 2012; 13, R42.
13. Dave M., Higgins P. D., Middha S., Rioux K. P. The human gut microbiome: current knowledge, challenges, and future directions. Trans. Res. 2012; 160, 246–257.
14. Wu G. D., Chen J., Hoffman Ch., Bittinger K., Chen Y. Y., Keilbaugh S. A., Bewtra M., Knights D., Walters W. A., Knight R., Sinha R., Gilroy E., Gupta K., Baldassano R., Nessel L., Li H., Bushman F. D., Lewis J. D. Linking tong-term dietary patterns with gut microbial enterotypes. Science 2011; 334, 105–108.
15. Faith J. J., Guruge J. L., Charbonneau M., Subramanian S., Seedorf H., Goodman A. L., Clemente J. C., Knight R., Heath A. C., Leibel R. L., Rosenbaum M., Gordon J. I. The long-term stability of the human gut microbiota. Science 2013; 341, 12377439.
16. Jiménez E., Marín M. L., Martín R., Odriozola J. M., Olivares M., Xaus J., Fernández L., Rodríguez J. M. Is meconium from healthy newborns actually sterile? Res. Microbiol. 2008; 159, 187–193.
17. Satokari R., Grönroos T., Laitinen K., Salminen S., Isolauri E. Bifidobacterium and Lactobacillus DNA in the human placenta. Lett. Appl. Microbiol. 2009; 48, 8–12.
18. Aagaard K., Ma J., Antony J. M., Ganu R., Petrosino J., Versalovic J. The placenta harbors a unique microbiome. Sci. Transl. Med. 2014; 6, 237ra265.
19. Huure A., Kalliomäki M., Rautava S., Rinne M., Salminen S., Isolauri E. Mode of delivery – effects on gut microbiota and humoral immunity. Neonatology 2008; 93, 236–240.
20. DiGiulio D. B., Romero R., Amogan H. P., Kusanovic J. P., Bik E. M., Gotsch F., Kim C. J., Erez O., Edwin S., Relman D. A. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One 2008; 3, e3056.
21. Dominguez-Bella M. G., Costello E. K., Contreras M., Magris M., Hidalgo G., Fierer N., Knight R. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc. Natl. Acad. Sci. USA 2010; 107, 11971–11975.
22. Bäckhed, F., Roswall, J., Peng, Y., Feng, Q., Jia, H., Kovatcheva-Datchary, P., Li Y., Xia Y., Xie H., Zhong H., Khan M. T., Zhang J., Li J., Xiao L., Al-Aama J., Zhang D., Lee Y. S., Kotowska D., Colding C., Tremaroli V., Yin Y., Bergman S., Xu X., Madsen L., Kristiansen K., Dahlgren J., Wang J. Dynamics and stabilization of the human gut microbiome during the first year of life. Cell Host Microbe 2015; 17, 690–703.
23. Lloyd-Price J., Abu-Ali G., Huttenhower C. The healthy human microbiome. Genome Med. 2016; 8, 51.
24. Zivkovic A. M., German J. B., Lebrilla C. B., Mills D. A. Human milk glycobiome and its impact on the infant gastrointestinal microbiota. Proc. Natl. Acad. Sci. USA 2011; 108, 4653–4658.
25. Charbonneau M. R., O´Donnell D., BLaton L. V., Totten S. M., Davis J. C., Barratt M. J., Cheng J., Guruge J., Talcott M., Bain J. R., Muehlbauer M. J., Ilkayeva O., Wu C., Struckmeyer T., Barile D., Mangani C., Jorgensen J., Fan Y. M., Maleta K., Dewey K. G., Ashorn P., Newgard C. B., Lebrilla C., Mills D. A., Gordon J. I. Salylated milk oligosaccharides promote microbiota-dependent growth models of infant undernutrition. Cell 2016; 164, 859–871.
26. Koenig J. E., Spor A., Scalfone N., Fricker A. D., Stombaugh J., Knight R., Angenent L. T., Ley R. E. Succession of microbial consortia in the developing infant gut microbiome. Proc. Natl. Acad. Sci. USA 2011; 108(Suppl 1), 4578–4585.
27. Yatsunenko T., Rey F. E., Manary M. J., Trehan I., Dominguez-Bello M. G., Contreras M., Magris M., Hidalgo G., Baldassano R. N., Anokhin A. P., Heath A. C., Warner B., Reeder J., Kuczynski J., Caporaso J. G., Lozupone C. A., Lauber C., Clemente J. C., Knights D., Knight R., Gordon J. I. Human gut microbiome viewed across age and geography. Nature 2012; 486, 222–227.
28. Monsen A. L., Refsum H., Markestad T., Ueland P. M. Cobalamin status and its biochemical merkers methylmalonic acid and homocysteine in different age groups from 4 days to 19 years. Clin. Chem. 2003; 49, 2067–2075.
29. Andersson A. F., Lindberg M., Jakobsson H., Bäckhed F., Nyrén P., Engstrand L. Comparative analysis of human gut microbiota by barcoded pyrosequencing. PLoS One 2008; 3, e2836.
30. Zwielehner J., Liszt K., Handschur M., Lassl C., Lapin A., Haslberger A. G. Combined PCR-DGGE fingerprinting and quantitative-PCR indicates shift in fecal population sizes and Clostridium cluster IV in institutionalized elderly. Exp. Gerontol. 2009; 44, 440–446.
31. Claesson M. J., Cusack S., O´Sullivan O., Greene-Diniz R., de Weerd H., Flannery E., Marchesi J. R., Falush D., Dinan T., Fitzgerald G., Stanton C., van Sinderen D., O‘Connor M., Harnedy N., O‘Connor K., Henry C., O‘Mahony D., Fitzgerald A. P., Shanahan F., Twomey C., Hill C., Ross R. P., O‘Toole P. W. Composition, variability, and temporal stability of the intestinal microbiota in elderly. Proc. Natl. Acad. Sci. USA 2011; 108 Suppl. 1, 4586–4591.
32. Petersen C., Round J. L. Defining dysbiosis and its influence on host immunity and disease. Cell Microbiol. 2014; 16, 1024–1033.
33. Round J. L., Lee S. M., Li J., Tran G., Jabri B., Chatila T. A., Mazmanian S. K. The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota. Science 2011; 332, 974–977.
34. Atarashi K., Tanoue T., Oshima K., Suda W., Nagano Y., Nishikawa H., Fukuda S., Saito T., Narushima S., Hase K., Kim S., Fritz J. V., Wilmes P., Ueha S., Matsushima K., Ohno H., Olle B., Sakaguchi S., Taniguchi T., Morita H., Hattori M., Honda K. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013; 500, 232–236.
35. Ospelt C, Gay S. TLRs and chronic inflammation. Int. J. Biochem. Cell Biol. 2010; 42, 495–505.
36. Frantz A. L., Rogier E. W., Weber C. R., Shen L., Cohen D. A., Fenton L. A., Bruno M. E., Kaetzel C. S. Targeted deletion of MyD88 in intestinal epithelial cells results in compromised antibacterial immunity associated with downregulation of polymeric immunoglobulin receptor, mucin-2, and antibacterial peptides. Mucosal Immunol. 2012; 5, 501–512.
37. Demeria D., Ewaschuk J., Madsen K. Interactions of Lactobacillus with immune system. Ljungh Å., Wadström T. eds. Lactobacillus molecular biology: from genomics to probiotics, 1st ed. Norfolk: Caister Academic Press 2009.
38. O’Hara A. M., Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006; 7, 688–693.
39. Lebeer S., Vanderleyden J., De Keersmaecke, S. C. J. Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Nat. Rev. 2010; 8, 171–184.
40. Erridge C., Pridmore A., Eley A., Stewart J., Poxton I. R. Lipopolysaccharides of Bacteroides fragilis, Chlamydia trachomatis and Pseudomonas aeruginosa signal through Toll-like receptor 2. J. Med. Microbiol. 2004; 53, 735–740.
41. Guani-Guerra E., Santoz-Mendoza T., Lugo-Reyes S. O., Terán L. M. Antimicrobial peptides: general overview and clinical implications in human health and disease. Clin. Immunol. 2010; 135, 1–11.
42. Ostaff M. J., Stange E. F., Wehkamp J. Antimicrobial peptides ad gut microbiota in homeostasis and pathology. EMBO Mol. Med. 2013; 5, 1465–1483.
43. Round J. L., Mazmanian S. K. The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol. 2009; 9, 313–323.
44. Clemente J. C., Ursell L.K., Wegener Perfrey W., Knight R. The impact of the gut microbiota on human health: an integrative view. Cell 2012; 148, 1258–1270.
45. Sartor R. B., Mazmanian S. K. Intestinal microbes in inflammatory bowel diseases. Am. J. Gastroenterol. Suppl. 2012; 1, 15–21.
46. Brown C. T., Sharon I., Thomas B. C., Castelle C. J., Morowitz M. J., Banfield J. F. Genome resolved analysis of a premature infant gut microbial community reveals a Varibaculum cambriese genome and a shift towards fermentation-based metabolism during the third week of life. Microbiome 2013; 1, 30.
47. Lemon K. P., Armitage G. C., Relman D. A., Fischbach M. A. Microbiota-targeted therapies: an ecological perspective. Sci. Transl. Med. 2012; 4, 137–135.
48. Costello E. K., Stagaman K., Dethlefsen L., Bohannan B. J., Relman D. A. The application of ecological theory toward an understanding of the human microbiome. Science 2012; 336, 1255–1262.
49. Burke C., Steinberg P., Rusch D., Kjelleberg S., Thomas T. Bacterial community assembly based on functional genes rather than species. Proc. Natl. Acad. Sci. USA 2011; 108, 14288–14293.
50. Turnbaugh P. J., Ley R. E., Hamady M., Fraser-Liggett C., Knight R., Gordon J. I. The human microbiome project. Nature 2007; 449, 804–810.
51. Flores G. E., Caporaso J. G., Henley J. B., Rideout J. R., Domogala D., Chase J., Leff J. W., Vázquez-Baeza Y., Gonzalez A., Knight R., Dunn R. R., Fierer N. Temporal variability is a personalized feature of the human microbiome. Genome Biol. 2014; 15, 531.
52. Blaser M. Who are we? EMBO Rep. 2006; 7, 956–960.
53. Strachan D. P. Hay fever, hygiene, and household size. BMJ 1989; 299, 1259–1260.
54. Cookson W. O., Moffatt M. F. Asthma: an epidemic in the absence of infection? Science 1997; 275, 41–42.
55. Swanson H. I. Drug metabolism by the host and gut microbiota: a partnership or rivalry? Drug Metab. Dispos. 2015; 43, 1499–1504.
56. McDermott A. J., Huffnagel G. B. The microbiome and regulation of mucosal immunity. Immunology 2014; 142, 24–31.
57. Maranduba C. M., De Castro S. B, de Souza G. T., Rossato C., da Guia F. C:, Valente M. A. S., Rettore J. V. P, Maranduba C. P., de Souza C. M., do Carmo A. M. R., Macedo G. C., de Sá Silva F. Intestinal microbiota modulators of the immune system and neuroimmune system: impact on the host health and homeostasis. J. Immunol. Res. 2015; 2015, 931574.
58. Blaser M., Falkow S. What are the consequences of the disappearing human microbiota? Nat. Rev. Microbiol. 2009; 7, 887–894.
59. Dethlefsen L., Huse S., Sogin M. L., Relman D. A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rDNA sequencing. PLoS Biol. 2008; 6, e280.
60. Sokol H., Pigneur B., Watterlot L., Lakhdari O., Bermúdez-Humarán L. G., Gratadoux J. J., Blugeon S., Bridonneau C., Furet J. P., Corthier G., Grangette C., Vasquez N., Pochart P., Trugnan G., Thomas G., Blottière H. M., Doré J., Marteau P., Seksik P., Langella P. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis o Crohn disease patients. Proc. Natl. Acad. Sci. USA 2008; 105, 16731–16736.
61. Rutter M., Saunders B., Wilkinson K., Rumbles S., Schofield G., Kamm M., Williams C., Price A., Talbot I., Forbes A. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology 2004; 126, 451–459.
62. Knights D., Lassen K. G., Xavier R. J. Advances in inflammatory bowel disease pathogenesis: linking host genetics and the microbiome. Gut 2013; 62, 1505–1510.
63. Collins S. M. A role for the gut microbiota in IBS. Nat. Rev. Gastroenterol. Hepatol. 2014; 11, 497–505.
64. Borges-Canha M., Portela-Cidade J. P., Dinis-Ribeiro M., Leite-Moreira A. F., Pimentel-Nunes P. Role of colonic microbiota in colorectal carcinogenesis: A systematic review. Rev. Esp. Enferm. Dig. 2015; 107, 659–671.
65. Hur K. Y., Lee MS. Gut microbiota and metabolic disorders. Diabetes Metab. J. 2015; 39, 198–203.
66. Aarslan N. Obesity, fatty liver disease and intestinal microbiota. World J. Gastroenterol. 2014; 20, 16452.
67. Horning M. The role of microbes and autoimmunity in the pathogenesis of neuropsychiatric illness. Cur. Opin Rheumatol 2013; 25, 488–795.
68. Fujimura K. E., Lynch S.V. Microbiota in allergy and asthma and the emerging relationship with the gut microbiome. Cell Host Microbe 2015; 17, 592–602.
69. Seekatz A. M., Young V. B. Clostridium difficile and the microbiota. J. Clin. Invest. 2014; 124, 4182.
70. Clarke G., Stilling R. M., Kennedy P. J., Stanton C., Cryan J. F., Dinan T. G. Minireview. Gut microbiota: the neglected endocrine organ. Mol. Endocrinol. 2014; 28, 1221–1238.
71. Ridaura V., Belkaid Y. Gut microbiota: the link to your second brain. Cell 2015; 161, 193–194.
72. Rhee S. H, Pothoulakis C., Mayer E. A. Principles and clinical implications of the brain-gut enteric microbiota axis. Nat. Rev. Gastroenterol. Hepatol. 2009; 6, 306–314.
73. Collins S. M., Surette M., Bercik P. The interplay between the intestinal microbiota and the brain. Na. Rev. Microbiol. 2012; 10, 735–742.
74. Rosenfeld C. S. Microbiome disturbances and autism spectrum disorders. Drug Metab. Dispos. 2015; 43, 1557–1571.
75. Marque A. H, O‘Connor T. G., Roth C., Susser E., Bjørke-Monsen A. L. The influence of maternal prenatal and early childhood nutrition and maternal prenatal stress on offspring immune system development and neurodevelopmental disorders. Front. Neurosci. 2013; 7, 120.
76. Bale T. L., Baram T. Z., Brown A. S., Goldstein J. M., Insel T. R., McCarthy M. M., Nemeroff C. B., Reyes T. M., Simerly R. B., Susser E. S., Nestler E. J. Early life programming and neurodevelopmental disorders. Biol. Psychiatry. 2010; 68, 314–319.
77. Mittal V. A., Ellman L. M., Cannon T. D. Gene-environmental interaction and covariation in schizophrenia: the role of obstetric complications. Schizophr. Bull. 2008; 34, 1083–1094.
78. Finegold S. M. State of art; microbiology in health and disease. Intestinal bacterial flora in autism. Anaerobe 2011; 17, 367–368.
79. Donnet-Hughes A., Perez P. F., Doré J., Leclerc M., Levenez F., Benyacoub J., Serrant P., Segura-Roggero I., Schiffrin E. J. Potential role of intestinal microbiota of the mother in neonatal immune education. Proc. Nutr. Soc. 2010; 69, 407–415.
80. Borre Y. E, O´Keeffe, G. W, Clarke G., Stanton C., Dinan T. G., Cryan J. F. Microbiota and neurodevelopmental windows: implications for brain disorders. Trends Mol. Med. 2014; 20, 509–518.
81. Marchesi J. R., Adams D. H., Fava F., Hermes G. D., Hirschfield G. M., Hold G., Quraishi M. N., Kinross J., Smidt H., Tuohy K. M., Thomas L. V., Zoetendal E. G., Hart A. The gut microbiota and host health: a new clinical frontier. Gut 2015; 65, 330–339.
Štítky
Adiktologie Biochemie Dětská onkologie Dětská psychiatrie Diabetologie Endokrinologie Farmacie Farmakologie Intenzivní medicína Interní lékařství Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé Psychiatrie Toxikologie Farmaceutický asistent
Článek Autorský rejstřík
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2017 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Nedůvěřivý pacient – tipy pro efektivní komunikaci v časové tísni
-
Všechny články tohoto čísla
- Črevná mikrobiota: jej vývin a vzťah k vzniku niektorých ochorení
- Velikostně redukované mikročástice na bázi Eudragitu® RS připravené metodou odpaření rozpouštědla – sledování vlivu vybraných proměnných na testované parametry
- Vývoj disolučnej metódy pre tablety s obsahom warfarínu sodného
- Karboxylové kyseliny z hnědých řas Fucus vesiculosus a Padina pavonica
- Sympozia Sekce dějin farmacie ČFS v roce 2017
- Zpráva z mezinárodního setkání historiků farmacie ve Varšavě
- Autorský rejstřík
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Črevná mikrobiota: jej vývin a vzťah k vzniku niektorých ochorení
- Vývoj disolučnej metódy pre tablety s obsahom warfarínu sodného
- Karboxylové kyseliny z hnědých řas Fucus vesiculosus a Padina pavonica
- Velikostně redukované mikročástice na bázi Eudragitu® RS připravené metodou odpaření rozpouštědla – sledování vlivu vybraných proměnných na testované parametry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



