-
Články
Reklama
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ReklamaBakteriocíny produkované baktériami mliečneho kvasenia
Bacteriocins produced by lactic acid bacteria
Lactic acid bacteria comprise several genera of gram–positive bacteria that are known for the production of structurally different antimicrobial substances. Among them, bacteriocins are nowadays in the centre of scientific interest. Bacteriocins, proteinaceous antimicrobial substances, are produced ribosomally and have usually a narrow spectrum of bacterial growth inhibition. According to their structure and the target of their activity, they are divided into four classes, although there are some suggestions for a renewed classification. The most interesting and usable class are lantibiotics. They comprise the most widely commercially used and well examined bacteriocin, nisin. The non-pathogenic character of lactic acid bacteria is advantageous for using their bacteriocins in food preservation as well as in feed supplements or in veterinary medicine.
Key words:
lactic acid bacteria – probiotics – bacteriocins – lantibiotics – nisin – biopreservation
Autoři: Andrea Bilková; Hana Kiňová Sepová; František Bilka; Andrea Balážová
Působiště autorů: Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 65-72
Kategorie: Přehledy a odborná sdělení
Souhrn
Medzi baktérie mliečneho kvasenia patrí niekoľko rodov gram pozitívnych baktérií, ktoré produkujú štruktúrne rôznorodé antimikróbne pôsobiace látky. V súčasnosti sú spomedzi nich v centre vedeckého záujmu práve bakteriocíny. Jedná sa o antimikróbne látky proteínovej povahy, ktoré sú produkované ribozomálne a majú zvyčajne úzke spektrum účinku na inhibíciu rastu baktérií. Podľa štruktúry a cieľa účinku ich rozdeľujeme do štyroch tried, ale existujú návrhy na vypracovanie nového spôsobu klasifikácie. Najzaujímavejšou a v praxi najvyužiteľnejšou triedou sú lantibiotiká, medzi ktoré patrí aj komerčne najpoužívanejší a najpreštudovanejší bakteriocín, nizín. Nepatogénny charakter baktérií mliečneho kvasenia je výhodný pre použitie nimi produkovaných bakteriocínov pri konzervovaní potravín, ako aj vo výživových doplnkoch alebo vo veterinárnej medicíne.
Kľúčové slová:
baktérie mliečneho kvasenia – probiotiká – bakteriocíny – lantibiotiká – nizín – biokonzerváciaÚvod
Pre schopnosť pozitívne modulovať imunitný systém hostiteľa a ovplyvniť zloženie jeho osídlenia mikroorganizmami v prospech užitočných druhov, sú mnohé druhy baktérií mliečneho kvasenia hojne využívané v probiotických prípravkoch. Medzi najvýznamnejšie rody baktérií mliečneho kvasenia patria Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus a Streptococcus, ktorých zástupcovia produkujú rôzne antimikróbne pôsobiace látky. Antibakteriálnou látkou, charakteristickou pre všetky baktérie mliečneho kvasenia, je kyselina mliečna. Laktát je u týchto mikroorganizmov konečným metabolitom odbúravania sacharidov. Popri kyseline mliečnej vznikajú pri fermentácii sacharidov aj iné antimikróbne pôsobiace organické kyseliny, ako napr. kyselina octová a propiónová. Niektoré kmene druhu Lactobacillus reuteri sú schopné využívať glycerol ako akceptor protónov vodíka, pričom vzniká antibakteriálna látka reuterín (3–hydroxypropiónaldehyd) 1). Iné kmene tohto druhu sa vyznačujú produkciou sekundárneho metabolitu reutericyklínu, prvého objaveného antibiotika, produkovaného baktériami mliečneho kvasenia 2). Okrem spomínaných látok sú baktérie mliečneho kvasenia významné pre produkciu bakteriocínov. Spomedzi gram pozitívnych baktérií sú ich najproduktívnejšou skupinou.
Bakteriocíny
Bakteriocíny sú peptidy alebo proteíny s antimikróbnou aktivitou syntetizované na ribozómoch baktérií. Jedná sa o pomerne rôznorodú skupinu látok, pričom producent má voči nim vyvinutú špecifickú rezistenciu. Ich spoločným ukazovateľom je relatívne úzke antimikróbne spektrum účinku a pomerne vysoká teplotná a pH stabilita 3). Pravdepodobne až 99 % všetkých baktérií je schopných produkovať aspoň jeden bakteriocín, ale ich tvorba je zatiaľ málo preskúmaná 4). Prvý bakteriocín bol objavený v roku 1925. Išlo o kolicín, ktorý bol pomenovaný podľa producenta – Escherichia coli 5). V súčasnosti je známych približne 200 bakteriocínov 6). Celú skupinu môžeme rozdeliť na dve veľké podskupiny: bakteriocíny produkované gram pozitívnymi (G+) baktériami a bakteriocíny produkované gram negatívnymi (G–) baktériami. Zásadným rozdielom medzi týmito podskupinami je počet génov zapojených do ich biosyntézy. V prípade bakteriocínov G+ baktérií je do biosyntézy zapojených oveľa viac génov, ako je tomu u bakteriocínov G – baktérií 7). Zatiaľ čo u G+ baktérií sú tieto gény zoskupené do klastrov po 8–12, u G – baktérií (napr. kolicíny E. coli), je klaster tvorený len 2–3 génmi, podieľajúcimi sa na ich produkcii 8).
Spomedzi bakteriocínov produkovaných G+ baktériami sú najlepšie preskúmané bakteriocíny baktérií mliečneho kvasenia. Tieto látky nachádzajú dôležité uplatnenie v potravinárstve pri fermentácii a konzervácii mäsa či mlieka 9). Líšia sa v spektre baktérií, voči ktorým pôsobia, ale vo všeobecnosti sú účinnejšie voči G+ druhom baktérií s nízkym obsahom GC motívov v genóme. Baktericídna aktivita voči G – baktériám bola dokázaná iba v prípadoch, keď tieto mali porušenú integritu vonkajšej membrány, napríklad účinkom chelatačných činidiel (EDTA) 10). Klaenhammer 11) rozdelil bakteriocíny baktérií mliečneho kvasenia do štyroch tried, ktoré sa ďalej členia na podtriedy (tab. 1).
Tab. 1. Príklady niektorých bakteriocínov, produkovaných BMK, zaradených do tried podľa Klaenhammera 11) 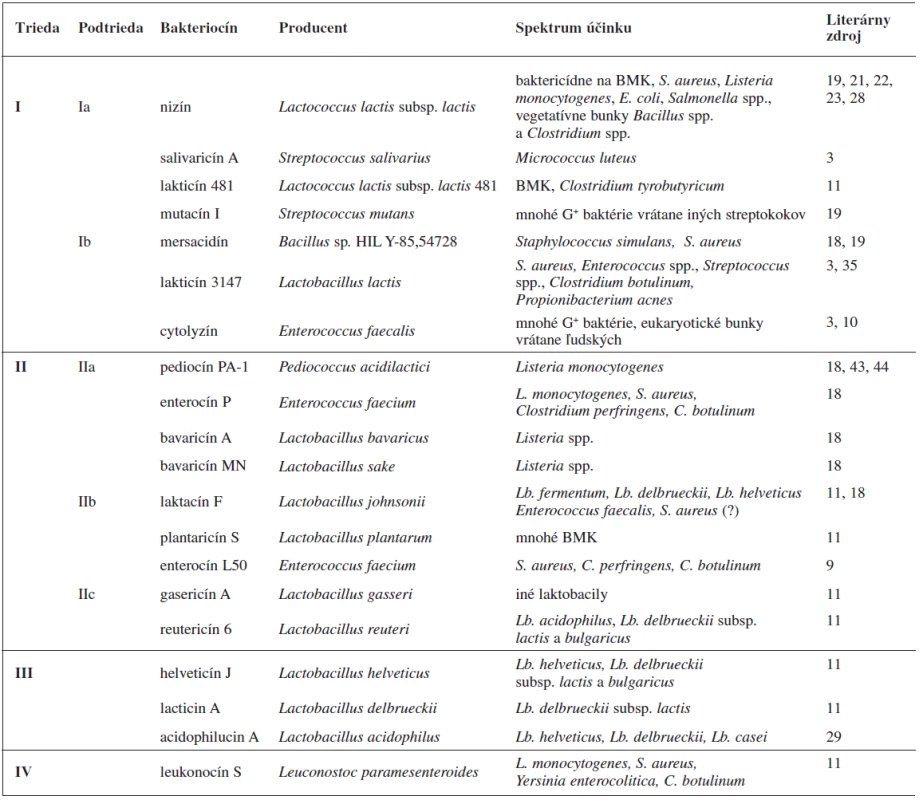
Podtrieda IIc je zaradená do tabuľky podľa Cottera a kol. 32); BMK – baktérie mliečneho kvasenia Trieda I, lantibiotiká, zahŕňa malé (< 5 kDa), posttranslačne modifikované peptidy o dĺžke 19–38 aminokyselín 12), ktoré sa vyznačujú nielen antibakteriálnymi, ale aj antivírusovými a protizápalovými aktivitami 13). Súčasťou ich polypeptidových reťazcov sú netypické aminokyseliny lantionín a ß-metyllantionín (obr. 1). Tieto netypické aminokyseliny sa podieľajú na tvorbe kovalentných tioéterových väzieb medzi aminokyselinami, ktoré vedú k formovaniu vnútorných kruhov v rámci polypeptidového reťazca. To dáva molekulám lantibiotík charakteristickú cyklickú štruktúru. Táto štruktúra im zabezpečuje vyššiu biologickú aktivitu a proteolytickú stabilitu v porovnaní s lineárnymi peptidmi 13). Lantibiotiká môžu obsahovať aj ďalšie netypické aminokyselinové zvyšky (dehydroalanín, dehydrobutyrín), ktoré vznikajú posttranslačnými modifikáciami 10). Lantionín a β-metyllantionín takisto vznikajú v rámci posttranslačných modifikácii v dvoch enzýmovo katalyzovaných reakciách: najprv sa uskutoční dehydratácia Ser alebo Thr zvyšku a potom intramolekulová adícia tiolovej skupiny Cys na dehydratovanú aminokyselinu. Výsledkom je krížová tioéterová väzba v polypeptidovom reťazci lantibiotika 14). Dnes sú známe tri mechanizmy tvorby tioéterových väzieb v lantibiotikách 13). Pri prvom spôsobe LanB dehydratázy konvertujú Ser resp. Thr zvyšky nachádzajúce sa v prekurzorových peptidoch na dehydroalanín (Dha), resp. (Z)–dehydrobutyrín (Dhb). Následne sú za katalýzy LanC cyklázy intramolekulovou Michaelovou adíciou Cys tiolov na Dha alebo Dhb formované typické lantionínové (Lan, vznikajú zo Ser) a metyllantionínové (MeLan, vznikajú z Thr) tioéterové krížové väzby. Pri druhom spôsobe sú lantibiotiká produkované bifunkčnými modifikačnými enzýmami LanM, ktoré sú zodpovedné za dehydratáciu aj cyklizáciu 15). Goto a kol. 13) popísali tretí spôsob tvorby lantibiotík, ktorý je katalyzovaný novoobjaveným typom lantionínsyntetáz. Tieto enzýmy nazvali LanL a pozostávajú z troch samostatných katalytických domén: Ser/Thr kinázovej domény, fosfoSer/Thr lyázovej domény a cyklázovej domény, podobnej LanC. Proteínkinázová doména zabezpečuje vznik dehydratovaných aminokyselín fosforyláciou Ser a Thr zvyškov, lyázová doména eliminuje fosfát a cyklázová doména katalyzuje pripojenie Cys zvyškov k dehydratovaným aminokyselinám a vznik charakteristických tioéterových kruhov 13).
Obr. 1. Štruktúra lantionínu – 1, ß-metyllantionínu – 2 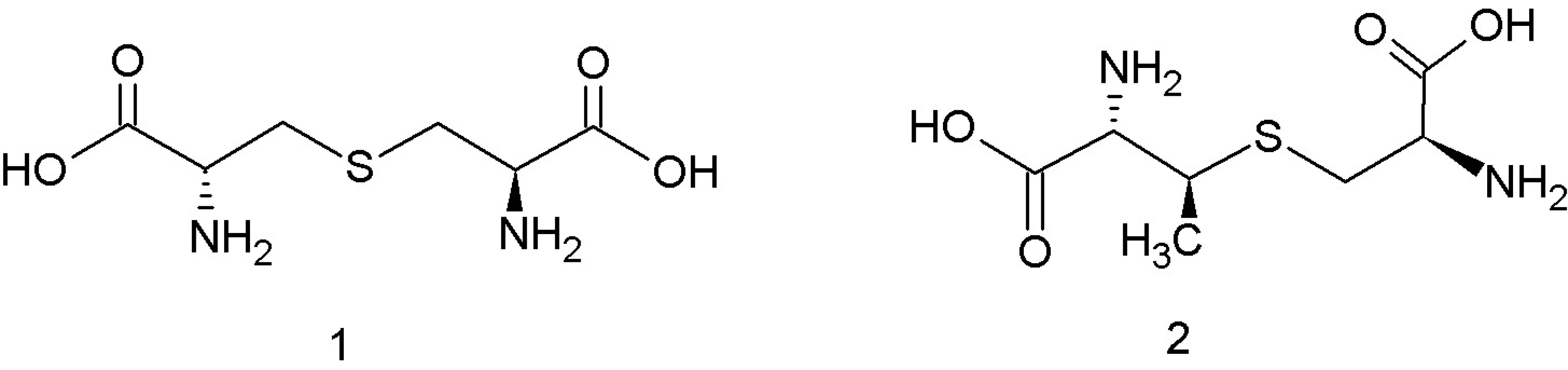
Lantibiotiká sú syntetizované v neaktívnej forme s N‑terminálnou signálnou sekvenciou, ktorá je počas maturácie z molekuly odštiepená a následne sa uvoľní aktívny peptid 16). Ich produkcia je regulovaná stratégiou „quorum sensing“. To znamená, že antimikróbny peptid slúži ako signálna molekula, na základe ktorej je kontrolovaná hustota bakteriálnej populácie, a zároveň slúži ako spúšťač regulačného systému, ktorý indukuje jeho vlastnú expresiu 17).
Na základe štruktúry a funkčných vlastností môžeme bakteriocíny I. triedy zaradiť do dvoch podtried.
Bakteriocíny podtriedy Ia majú kladný náboj a sú amfifilné 18). Do tejto podtriedy patria napr. nizín, salivaricín A, lakticín 481, mutacín 19). Ako prvý z nich bol popísaný nizín v roku 1928 Rogersom 20) a v súčasnosti patrí medzi najčastejšie používané komerčne dostupné bakteriocíny. Využíva sa vo viac ako 40 krajinách pri spracovaní syra a iných mliečnych produktov a pri konzervovaní potravín už vyše 50 rokov 21–23). V praxi sa používa pod označením E234. Produkujú ho niektoré kmene Lactococcus lactis a pôsobí baktericídne na väčšinu baktérií mliečneho kvasenia, Staphylococcus aureus, Listeria monocytogenes, Escherichia coli, Salmonella spp., vegetatívne bunky Bacillus spp. a Clostridium spp. Molekula nizínu pozostáva z 34 aminokyselinových zvyškov a má pentacyklickú štruktúru s jedným lantionínovým zvyškom v kruhu A a štyrmi β-metyllantionínovými zvyškami v kruhoch B, C, D a E (obr. 2) 24–26). Momentálne je známych šesť rôznych molekúl nizínu, ktoré sa líšia v primárnej štruktúre proteínu: nizín A, nizín F, nizín Q, nizín U, nizín U2 a nizín Z 27). Nizín využíva najmenej dva mechanizmy účinku. Prvý spočíva v tvorbe pórov v cytoplazmatickej membráne atakovanej bunky. Pri mikromolárnych koncentráciách nizínu sa na artificiálnych membránach tvoria tzv. „non-targeted“ póry. V prípade týchto pórov molekula nizínu interaguje svojou polárnou časťou molekuly (C-koniec) iónovými silami s polárnou hlavičkou fosfolipidov membrány, čo spôsobí lokálne narušenie fosfolipidovej dvojvrstvy a hydrofóbna časť molekuly (N-koniec) sa môže zasunúť do vnútra membrány. Následne sa C-koniec nizínu translokuje z vonkajšej strany membrány na vnútornú. Na krátky čas (rádovo v milisekundách) sa vytvorí pór, dôsledkom čoho je strata membránového potenciálu a únik malých metabolitov (napr. ATP a aminokyselín) z bunky. Pretože nizín zabíja baktérie aj pri nanomolárnych koncentráciách, musí existovať aj iný mechanizmus tvorby pórov. Model takéhoto mechanizmu si vyžaduje prítomnosť cieľovej molekuly, na ktorú sa nizín špecificky naviaže. Touto molekulou je membránovo viazaný lipid II, ktorý je prekurzorom peptidoglykánu. Nizín N-koncom svojej molekuly interaguje s lipidom II, čím príde ku konformačnej zmene v molekule, ktorá umožní inzerciu C-koncovej časti do membrány a vznik póru. Interakcia nizínu s lipidom II stabilizuje transmembránovú orientáciu nizínu. Navyše, väzbou nizínu na lipid II sa inhibuje aj syntéza peptidoglykánu.
Obr. 2. Primárna štruktúra nizínu. Dha – dehydroalanín, Dhb – dehydrobutyrín, Abu – kyselina 2-aminobutyrová (podľa Cottera a kol.) <sup>32)</sup> 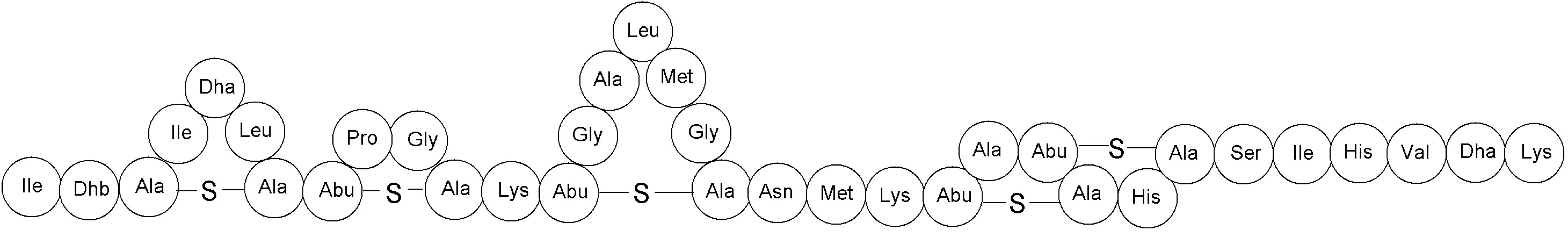
Okrem týchto dvoch mechanizmov u citlivých kmeňov stafylokokov nizín indukuje aj ich autolýzu, výsledkom ktorej je masívna degradácia bunkovej steny. Deje sa tak vďaka nizínom navodenému uvoľneniu enzýmov N-acetylmuramoyl-L-alanínamidázy a N-acetylglukozaminidázy. Tieto dva enzýmy sú silné katiónové proteíny, viazané elektrostatickými silami na bunkovú stenu. Silná väzba na membránu ich udržuje v inaktívnom stave – do aktívneho stavu sa dostanú práve po uvoľnení účinkom nizínu. Mechanizmy účinku nizínu sú podrobne popísané v prácach Hécharda a Sahla 18) a Bauera a Dicksa 28).
V skupine génov pre biosyntézu nizínu boli identifikované popri géne pre tvorbu prepeptidu (nisA) aj gény pre enzýmy zabezpečujúce modifikáciu aminokyselín (nisB, nisC), odštiepenie vedúceho peptidu (nisP), sekréciu (nisT), imunitu (nisI, nisFEG) a dva gény regulujúce expresiu (nisR, nisK) 29). Biosyntéza nizínu je regulovaná dvojzložkovým systémom, ktorý pozostáva z proteínového receptora pre membránovo viazanú histidínkinázu NisK a regulátora NisR. Odpoveď regulačného systému na zvýšenú extracelulárnu hladinu nizínu sa prejaví vo zvýšení expresie génov zodpovedných za imunitu (t.j. odolnosť samotného producenta na ním produkovaný nizín), syntézu a posttranslačné úpravy tohto lantibiotika 30). Uvedený regulačný mechanizmus je základom pre vyrovnaný expresný systém indukovaný nizínom („nisin–induced controlled expression system“, NICE) 31).
Podtrieda Ib obsahuje globulárne peptidy bez náboja alebo s negatívnym nábojom (napr. cinamycín, mersacidín, aktagardín, lakticín 3147) 33). Pôvodne sa predpokladalo, že lantibiotiká podtriedy Ib účinkujú prostredníctvom inhibície enzýmov, zapojených do biosyntézy bunkovej steny baktérií. Neskôr sa ukázalo, že niektoré z nich majú podobne ako lantibiotiká podtriedy Ia kombinovaný mechanizmus účinku, t.j. inhibujú syntézu bunkovej steny a zároveň sa podieľajú na tvorbe pórov v cytoplazmatickej membráne. To pomáha vysvetliť ich mimoriadne vysokú aktivitu, niektoré sú účinné už v nanomolárnej koncentrácii. Cieľovou molekulou mersacidínu, aktagardínu a lakticínu 3147 je lipid II, v prípade cinamycínu podobných lantibiotík ako ich väzbové miesto slúži membránový fosfolipid fosfatidyletanolamín 34).
In vitro pokusy ukázali, že dvojpeptidový bakteriocín lakticín 3147 je účinný voči S. aureus (vrátane meticilín–oxacilín rezistentných kmeňov), enterokokom (vrátane enterokokov rezistentných na vankomycín), streptokokom (Streptococcus pneumoniae, S. pyogenes, S. agalactiae, S. dysgylactiae, S. uberis, S. mutans), Clostridium botulinum a Propionibacterium acnes 35). Lakticín 3147 pôsobí prostredníctvom vzájomnej kooperácie aktivity oboch lantionín-obsahujúcich peptidov, pričom oba tieto peptidy sú potrebné pre zabezpečenie optimálnej aktivity bakteriocínu 36). Šesť génov zabezpečujúcich produkciu lakticínu 3147 je lokalizovaných na prenosnom plazmide pMRC01 so známou sekvenciou nukleotidov (60,2 kb). Produkty troch z nich sú zodpovedné za posttranslačné úpravy, konkrétne dehydratáciu a tvorbu Lan kruhov, a za export lakticínu 3147 z bakteriálnej bunky 37). Ďalšie dva gény kódujú malé prepropeptidy, pravdepodobne tiež zohrávajúce úlohu v tvorbe lantionínových kruhov 11, 38). Funkcia šiesteho génu zatiaľ nie je objasnená 37).
Cytolyzín, enterokokálne dvojpeptidové lantibiotikum, vykazuje cídnu aktivitu voči širokému spektru bunkových typov, t.j. nielen voči mnohým G+ baktériám, ale aj voči eukaryotickým bunkám vrátane ľudských, hovädzím a konským erytrocytom, polymorfonukleárnym leukocytom, bunkám črevného epitelu a i. 10).
Do triedy II sú začlenené malé (< 10 kDa), termostabilné, lantionín neobsahujúce peptidy, ktoré nepodliehajú posttranslačnej modifikácii. Väčšina z nich spôsobuje zvýšenie permeability cytoplazmatickej membrány cieľovej bunky s následným únikom molekúl z cytoplazmy. Aktívne sú už v nanomolárnych koncentráciách. Do podtriedy IIa patrí pediocín PA-1 a jemu podobné peptidy, napr. enterocín P, bavaricín A, bavaricín MN a i. 19, 39, 40). Ich antimikróbne spektrum účinku je úzke, ale všetky vykazujú vysokú špecifickú aktivitu voči potravinovému patogénu Listeria monocytogenes 18). Tieto peptidy majú konzervovanú sekvenciu na N-konci – „pediocínový box“ (Tyr-Gly-Asn-Gly-Val) a dva cysteíny umiestnené v N-terminálnej časti peptidu tvoriace disulfidový mostík. Mechanizmus interakcie týchto bakteriocínov s membránou atakovanej bunky nie je zatiaľ známy. Jedným z možných vysvetlení je interakcia pozitívne nabitých a polárnych aminokyselinových zvyškov bakteriocínov podtriedy IIa s aniónmi fosfolipidov v cytoplazmatickej membráne, avšak detaily tejto interakcie neboli dosiaľ objasnené 41). Predpokladá sa aj, že prítomnosť „pediocin boxu“ v molekule bakteriocínu je zodpovedná za nešpecifickú väzbu bakteriocínu na povrch cieľovej bunky. C-terminálny koniec peptidu je menej konzervovaný a má hydrofóbny alebo amfifilný charakter. Vďaka tomu pravdepodobne penetruje do hydrofóbnych častí membrány cieľovej bunky a spôsobuje uvoľňovanie vnútorného obsahu bunky 42). Typickým bakteriocínom podtriedy IIa je pediocín PA-1. Je produktom Pediococcus acidilactici a pozostáva zo 44 aminokyselinových zvyškov (Mr 4,6 kDa). Na jeho produkcii a exporte sa zúčastňujú produkty génov lokalizovaných v rámci pediocínového operónu (pedABCD) 43). V potravinárstve sa pediokoky uplatňujú pri príprave kvasenej zeleniny a mäsa 44). V mliečnych produktoch rastú obmedzene, pretože nie sú schopné utilizovať laktózu 45).
Bakteriocíny, tvorené dvoma peptidovými reťazcami s odlišnými aminokyselinovými sekvenciami spadajú do podtriedy IIb (napr. laktacín F, laktokocín G, plantaricín S, enterocín L50 a i.) 19, 46, 47). Pre biologickú aktivitu týchto molekúl sú potrebné oba peptidové reťazce 21). Mechanizmus ich účinku je založený na strate membránového potenciálu atakovanej bunky, úniku iónov z cytoplazmy a/alebo znížení intracelulárnej koncentrácie ATP 48).
Niektorí autori vydeľujú v rámci II. triedy bakteriocínov aj podtriedu IIc. Do tejto skupiny zaraďujú bakteriocíny, ktoré sú vylučované z bakteriálnej bunky tzv. sec-systémom 7), ktorý slúži na translokáciu preproteínov, obsahujúcich N-terminálnu signálnu sekvenciu cez cytoplazmatickú membránu. Cintas a kol. 49) sa prikláňajú k zrušeniu tejto podtriedy, nakoľko exkrécia bakteriocínov z bunky sec-systémom bola zistená aj u bakteriocínov podtriedy IIa. Aby mohli bakteriocíny IIc podtriedy využívať sekrečný sec-systém, musia byť ich cysteínové zvyšky najskôr oxidované. Eijsink a kol. 50) do podtriedy IIc radia posttranslačne nemodifikované bakteriocíny, ktoré nepatria do podtried IIa a IIb. Cotter a kol. 32) začleňujú do tejto podtriedy nemodifikované bakteriocíny s cyklickou štruktúrou, pričom na základe homológie aminokyselinových sekvencií navrhujú vytvorenie ďalších dvoch systematických podjednotiek: enterocín AS48 zaraďujú do IIc(i) a gasericín A a reutericín 6 do IIc(ii).
Do triedy III patria podľa Klaenhammera 11) vysokomolekulárne termolabilné bakteriocíny (> 30 kDa). Cotter a kol. 32) ich kvôli výraznej odlišnosti od ostatných bakteriocínov nazývajú bakteriolyzíny. Od iných bakteriocínov sa odlišujú mechanizmom účinku: spôsobujú hydrolýzu bunkovej steny citlivej bunky, čo má za následok lýzu bunky 32). Patria sem extracelulárne enzýmy niektorých druhov baktérií, napr. hemolyzíny (lyzujú erytrocyty) a muramidázy (štiepia glykozidové väzby peptidoglykánu v bunkovej stene baktérií) 51). Tieto proteíny vykazujú na N-konci homológiu s endopeptidázami, kým C-koniec je pravdepodobne zodpovedný za rozpoznávanie cieľového miesta na povrchu atakovanej bunky 52, 53).
Bakteriocíny tvoriace veľké komplexy s inými makromolekulami (polysacharidy, lipidy) patria do triedy IV 11). Antibakteriálnu aktivitu týchto bakteriocínov podmieňuje prítomnosť makromolekuly. Táto skupina bakteriocínov je zatiaľ málo preskúmaná 53).
Autori Zouhir a kol. 54) navrhujú nové prerozdelenie bakteriocínov G+ baktérií. Podľa homológie sekvenčných motívov navrhujú vytvorenie dvanástich skupín týchto bakteriocínov. Nové delenie má výhodu v tom, že už viac nedochádza k zaradeniu jedného bakteriocínu do viacerých tried, ako tomu bolo v niektorých prípadoch pri delení podľa Klaenhammera 11).
Pri biokonzervácii potravín majú bakteriocíny mliečnych baktérií viacero výhod. Ich producentmi sú mikroorganizmy, ktoré sú všeobecne považované za bezpečné a pre eukaryotické bunky nie sú toxické. Okrem toho sú termostabilné a odolné voči zmenám pH. Vykazujú baktericídnu aktivitu voči širokému spektru potravinových patogénov a baktériám vyskytujúcim sa v pokazených potravinových produktoch. Benefitom používania bakteriocínov pri konzervovaní potravín je aj zníženie spotreby iných chemických konzervantov. Pri spracovaní potravín je možné použiť nižšie teploty a zároveň dodržať mikrobiologickú bezpečnosť a zachovať vitamíny, ako aj organoleptické vlastnosti potravín 55). Bakteriocíny môžu byť do potravín pridávané dvoma cestami: 1. ex situ produkované v kultivačných médiách, alebo 2. produkciou in situ 56, 57). Pri produkcii bakteriocínov ex situ môže byť problémom purifikácia a tiež ich zakoncentrovanie, čím môžu stúpať finančné náklady. Ďalším problémom môže byť legislatíva pri povoľovaní používania danej látky 58). Naopak, produkcia bakteriocínov v potravinách in situ má viacero výhod. Producentské bunky baktérií môžu byť priamo pridávané do výrobkov ako štartovacie kultúry, ako prídavky alebo ako kokultúry v kombinácii so štartovacou kultúrou, prípadne ako protektívne kultúry (hlavne v prípade nefermentovaných potravín) 27). Použitie producentských kultúr však vyžaduje zváženie viacerých selekčných kritérií. Použitý kmeň musí byť schopný adaptácie na ekologické podmienky daného produktu a musí byť schopný množiť sa v ňom. Taktiež musí byť odolný voči technologickému spracovaniu a spôsobu uchovávania potraviny. Mal by produkovať bakteriocín v takom množstve, aby inhiboval rast cieľových patogénov a baktérií zodpovedných za kazenie potravín 58). Naviac treba vziať do úvahy, že potraviny tvoria komplexný ekosystém so širokou škálou mikroorganizmov, ktoré medzi sebou interagujú. V in vitro podmienkach bola pozorovaná aj závislosť medzi produkciou bakteriocínov a niektorými vonkajšími faktormi, ako napr. pH, teplota alebo zloženie rastového média 59). Skutočnosť, že gény, kódujúce bakteriocíny sú lokalizované na plazmidoch dáva do budúcnosti možnosť ich úprav genetickými manipuláciami 58).
Na hľadanie potenciálnych génov kódujúcich bakteriocíny bol vyvinutý softvér BAGEL (Bacteriocin Genome Mining Tool, http://bioinformatics.biol. rug.nl/websoftware/bagel), ktorý je prepojený s génovou bankou, GenBank (www.ncbi.nih.com/ genomes/ bacteria). Tento webový nástroj uľahčuje hľadanie a vzájomné porovnávanie génov pre bakteriocíny, ako aj génov zapojených do ich biosyntézy 6).
Iným webovým nástrojom je databáza bakteriocínov, BACTIBASE (http://bactibase.pfba-lab-tun.org), ktorá sumarizuje dosiaľ identifikované a charakterizované bakteriocíny aj s prepojením na príslušné publikácie v databáze PubMed. Databáza obsahuje údaje o štruktúre bakteriocínov, ich aminokyselinové sekvencie, 3D štruktúry (ak sú známe), ale aj údaje o fyzikálno-chemických vlastnostiach, ako je percentuálny obsah jednotlivých aminokyselín, izoelektrický bod, alebo relatívna molekulová hmotnosť. V databáze je možné hľadať jednotlivé látky na základe aminokyselinovej sekvencie, sekvencie je možné navzájom porovnávať alebo vyhľadávať bakteriocíny pomocou taxonomického vyhľadávača 60). V januári 2011 bolo v databáze BACTIBASE zaradených 197 bakteriocínov, pričom 176 z nich produkujú G+ baktérie, 18 G – baktérie a tri sú produktmi halobaktérií. Zo skupiny G+ baktérií sú dominantnými producentmi baktérie mliečneho kvasenia, z radu Lactobacillales eviduje BACTIBASE 127 bakteriocínov.
Oba vyššie spomenuté webové nástroje sú užitočnými pomôckami nielen pre oblasť základného výskumu, ale majú slúžiť aj pri výbere bakteriocínov pre spracovanie a konzervovanie potravín a tiež pri vývoji nových antimikróbnych liečiv pre medicínsku prax.
ZÁVER
Tento článok, venovaný bakteriocínom, nadväzuje na prehľadný článok 61), zaoberajúci sa antimikróbne pôsobiacimi látkami, produkovanými baktériami mliečneho kvasenia inej ako peptidovej štruktúry.
Časté a neuvážené používanie antibiotík v humánnej a veterinárnej medicíne spôsobuje v posledných desaťročiach nárast počtu patogénnych mikroorganizmov rezistentných voči antibiotikám, používaným v klinickej praxi. Nakoľko objav a vývoj nových účinných molekúl antibiotík v súčasnosti stagnuje, stále väčšia pozornosť sa sústreďuje na iné antimikróbne pôsobiace látky. Veľmi perspektívnymi pre použitie vo farmaceutickom a potravinárskom priemysle sa javia práve bakteriocíny produkované baktériami mliečneho kvasenia. Vďaka možnosti špecifického výberu medzi široko a úzko spektrálnymi bakteriocínmi a ich možnej kombinácii sa dá predpokladať, že nevznikne voči nim rezistencia. Sľubnými sa ukazujú najmä lantibiotiká, ktoré nie sú toxické pre eukaryotické bunky a sú účinné voči mnohým ľudským a zvieracím patogénom. Významné pokroky v biotechnológiách dávajú možnosť geneticky modifikovať bakteriálne bunky a pripraviť produkčné kmene schopné nadprodukcie cielene upravených antimikróbnych látok so želaným efektom.
Došlo 27. ledna 2011
Přijato 2. února 2011
Adresa pre korešpodenciu:
Mgr. Andrea Bilková, PhD.
Katedra bunkovej a molekulárnej biológie liečiv FaF UK
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: bilkova@fpharm.uniba.sk
Zdroje
1. Sobolov, M., Smiley, K. L.: Metabolism of glycerol by an acrolein–forming lactobacillus. J. Bacteriol. 1960; 79, 261–266.
2. Messens, W., De, V. L.: Inhibitory substances produced by lactobacilli isolated from sourdoughs – a review. Int. J. Food Microbiol. 2002; 72, 31–43.
3. Riley, M. A., Chavan, M. A.: Introduction. In: Riley, M. A., Chavan, M. A., eds. Bacteriocins: Ecology and Evolution, 1st ed. Berlin, Springer-Verlag, 2007.
4. Klaenhammer, T. R.: Bacteriocins of lactic acid bacteria. Biochim. 1988; 70, 337–349.
5. Gratia, A.: Sur un remarquable example d’antagonisme entre deux souches de colibacille. Comp. Rend. Soc. Biol. 1925; 93, 1040–1042.
6. de Jong, A., van Hijum, A. F. T., Bijlsma, J. J. E., Kok, J., Kuipers, O. P.: BAGEL: a web-based bacteriocin genome mining tool. Nucl. Acids Res. 2006; 34, W273–W279.
7. Nes, I. F., Diep, D. B., Havarstein, L. S., Brurberg, M. B., Eijsink, V., Holo, H.: Biosynthesis of bacteriocins in lactic acid bacteria. Antonie Leeuwenhoek 1996; 70, 113–128.
8. Riley, M. A., Wertz, J. E.: Bacteriocin diversity: ecological and evolutionary perspectives. Biochimie 2002; 84, 357–364.
9. Cintas, L. M., Casaus, M. P., Havarstein, L. S., Hernandez, P. E., Nes, I. F.: Bacteriocins of lactic acid bacteria. Food Sci. Technol. Int. 2001; 7, 281–305.
10. Tobajas, M., Mohedano, A. F., Casas, J. A., Rodríguez, J. J.: A kinetic study of reuterin production by Lactobacillus reuteri PRO 137 in resting cells. Biochem. Eng. J. 2007; 35, 218–225.
11. Klaenhammer, T.: Genetics of bacteriocins produced by lactic acid bacteria. FEMS Microbiol. Rev. 1993, 12, 39–85.
12. Konings, W. N., Kok, J., Kuipers, O. P., Poolman, B.: Lactic acid bacteria: the bugs of the new millenium. Curr. Opin. Microbiol. 2000; 3, 276–282.
13. Goto, Y., Li, B., Claesen, J., Shi, Y., Bibb, M. J., van der Donk, W. A.: Discovery of unique lanthionine synthetases reveals new mechanistic and evolutionary insights. PloS Biol. 2010; http://www.plosbiology.org/ article/info%3Adoi%2F10.1371%2Fjournal.pbio.1000339 (21.01.2011).
14. Willey, J. M., van der Donk, W. A.: Lantibiotics: peptides of diverse structure and function. Annu. Rev. Microbiol. 2007; 61, 477–501.
15. Xie, L., Miller, L. M., Chatterjee, C., Averin, O., Kelleher, N. L., van der Donk, W. A.: Lacticin 481: in vitro reconstitution of lantibiotic synthetase activity. Science 2004; 303, 679–681.
16. de Vos, W. M., Kuipers, O. P., van der Meer, J. R., Siezen, R. J.: Maturation pathway of nisin and other lantibiotics: post-translationally modified antimicrobial peptides exported by gram-positive bacteria. Mol. Microbiol. 1995; 17, 427–437.
17. Quadri, L. E.: Regulation of antimicrobial peptide production by autoinducer-mediated quorum sensing in lactic acid bacteria. Antonie Leeuwenhoek 2002; 82, 133–145.
18. Héchard, Y., Sahl, H. G.: Mode of action of modified and unmodified bacteriocins from gram-positive bacteria. Biochimie 2002; 84, 545–557.
19. Heng, N. C. K., Wescombe, P. A., Burton, J. P., Jack, R. W., Tagg, J. R.: The diversity of bacteriocins produced by gram-positive bacteria. In: Riley, M. A., Chavan, M. A., eds. Bacteriocins: Ecology and Evolution, 1st ed. Berlin, Springer-Verlag, 2007.
20. Rogers, L.: The inhibiting effect of Streptococcus lactis on Lactobacillus bulgaricus. J. Bacteriology 1928; 16, 321–325.
21. Delves-Broughton, J.: Nisin and its uses as a food preservative. Food Technol. 1990; 40, 100–117.
22. Cleveland, J., Montville, T. J., Nes, I. F., Chikindas, M. L.: Bacteriocins: natural antimicrobials for food preservation. Int. J. Food Microbiol. 2001; 71, 1–20.
23. Twomey, D., Ross, R. P., Ryan, M., Meany, B., Hill, C.: Lantibiotics produced by lactic acid bacteria: structure, function and applications. Antonie Leeuwenhoek 2002; 82, 165–185.
24. Gross, A., Morell, J. L.: Structure of nisin. J. Am. Chem. Soc. 1971; 93, 4634–4635.
25. Shiba, T., Wakamiya, T., Fukase, K., Ueki, Y., Teshima, T., Nishikawa, M.: Structure of the lanthionine peptides nisin, ancovenin and lanthiopeptin. In: G. Jung and H.-G. Sahl eds. Nisin and novel lantibiotics, 1st ed. Leiden, ESCOM Science Publishers, 1991.
26. Ross, R. P., Morgan, S., Hill, C.: Preservation and fermentation: past, present and future. Int. J. Food Microbiol. 2002; 79, 3–16.
27. Carminati, D., Giraffa, G., Quiberoni, A., Binetti, A., Suárez, V., Reinheimer, J.: Advances and trends in starter cultures for dairy fermentations. In: Mozzi, F., Raya, R. R., Vignolo, G. M., eds. Biotechnology of lactic acid bacteria: Novel applications, 1st ed. Oxford, Wiley-Blackwell, 2010.
28. Bauer, R., Dicks, L. M. T.: Mode of action of lipid II–targeting lantibiotics. Int. J. Food Microbiol 2005; 101, 201–216.
29. Riley, M. A., Wertz, J. E.: Bacteriocins: evolution, ecology, and application. Annu. Rev. Microbiol. 2002; 56, 117–137.
30. Kuipers, O. P., Beerthuyzen, M. M., de Ruyter, P. G. G. A., Luesink, E. J., de Vos, W. M.: Autoregulation of nisin biosynthesis in Lactococcus lactis by signal transduction. J. Biol. Chem. 1995, 20, 27299–27304.
31. De Vos, W. M.: Gene expression systems for lactic acid bacteria. Curr. Opin. Microbiol. 1999; 2, 289–295.
32. Cotter, P. D., Hill, C., Ross, R. P.: Bacteriocins: developing innate immunity for food. Nature Rev. Microbiol. 2005; 3, 777–788.
33. Altena, K., Guder, A., Cramer, C., Bierbaum, G.: Biosynthesis of the lantibiotic mersacidin: organization of a type B lantibiotic gene cluster. Appl. Environ. Microbiol. 2000; 66, 2565–2571.
34. Machaidze, G., Seelig, J.: Specific binding of cinnamycin (Ro 09-0198) to phosphatidylethanolamine. Comparison between micellar and membrane environments. Biochemistry 2003; 42, 12570–12576.
35. Galvin, M. H., Ross, R. P.: Lacticin 3147 displays activity in buffer against gram-positive bacterial pathogens which appear insensitive in standard plate assays. Lett. Appl. Microbiol. 1999, 28, 355–358.
36. Ryan, M. P., Jack, R., Josten, W., Sahl, H.-G., Jung, G., Ross, R. P., Hill, C.: Extensive post–translational modification, including serine to D-alanine conversion, in the two-component lantibiotic, lacticin 3147. J. Biol. Chem. 1999; 274, 37544–37550.
37. Dougherty, B., Hill, C., Wiedman, J., Richardson, D. R., Venter, J. C., Ross, R. P.: Sequence and analysis of the 60-kb conjugative, bacteriocin producing plasmid pMRC01 from Lactococcus lactis DPC3147. Mol. Microbiol. 1998; 29, 1029–1038.
38. Gilmore, M. S., Segarra, R. A., Booth, M. C., Bogie, C. P., Hall, L. R., Clewell, D. B.: Genetic structure of the Enterococcus faecalis plasmid pAD1-encoded cytolytic toxin system and its relationship to lantibiotic determinants. J. Bacteriol. 1994; 176, 7335–7344.
39. Larsen, A. G., Vogensen, F. K., Josephsen, J.: Antimicrobial activity of lactic acid bacteria isolated from sour doughs: purification and characterization of bavaricin A, a bacteriocin produced by Lactobacillus bavaricus MI401. J. Appl. Bacteriol. 1993; 75, 113–122.
40. Kaiser, A. L., Montville, T. J.: Purification of the bacteriocin bavaricin MN and characterization of its mode of action against Listeria monocytogenes Scott A cells and lipid vesicles. Appl. Environ. Microbiol. 1996; 62, 4529–4535.
41. Ennahar, S., Sashihara, S., Sonomoto, K., Ishizaki, A.: Class IIa bacteriocins: biosynthesis, structure and activity. FEMS Microbiol. Rev. 2000; 24, 85–106.
42. Kazazic, M. M., Nissen-Meyer, J., Fimland, G.: Mutational analysis of the role of charged residues in target-cell binding, potency and specificity of the pediocin-like bacteriocin sakacin P. Microbiology 2002; 148, 2019–2027.
43. Eom, J. E., Moon, S. K., Moon G.-S.: Heterologous production of pediocin PA-1 in Lactobacillus reuteri. J. Microbiol. Biotechnol. 2010; 20, 1215–1218.
44. Knorr, D.: Technology aspects related to microorganisms in functional foods. Trends Food Sci. Technol. 1998; 9, 295–306.
45. Papagianni, M., Anastasiadou, S.: The bacteriocins of pediococci. Sources, production, properties and applications. Microbial Cell Factories 2009; 8, 3–19.
46. Stephens, S. K., Floriano, B., Cathcart, D. P., Bayley, S. A., Witt, V. F., Jiménez-Díaz, R., Warner, P. J., Ruiz-Barba, J. L.: Molecular analysis of the locus responsible for production of plantaricin S, a two-peptide bacteriocin produced by Lactobacillus plantarum LPCO10. Appl. Environ. Microbiol. 1998; 64, 1871–1877.
47. Cintas, L. M., Casaus, P., Herranz, C., HĆvarstein, L. S., Holo, H., Hernández, P. E., Nes, I. F.: Biochemical and genetic evidence that Enterococcus faecium L50 produces enterocins L50A and L50B, the sec-dependent enterocin P, and a novel bacteriocins secreted without an N-terminal extension termed enterocin Q. J. Bacteriol. 2000; 182, 6806–6814.
48. Garneau, S., Martin, N. I., Vederas, J. C.: Two-peptide bacteriocins produced by lactic acid bacteria. Biochimie 2002; 84, 577–592.
49. Cintas, L. M., Casaus, P., Hararstein, L. S., Hernandez, P. E., Nes, I. F.: Biochemical and genetic characterization of enterocin P, a novel sec-dependent bacteriocin from Enterococcus faecium P13 with a broad antimicrobial spectrum. Appl. Environ. Microbiol. 1997; 63, 4321–4330.
50. Eijsink, V. G., Axelsson, L., Diep, D. B., Havarstein, L. S., Holo, H., Nes, I. F.: Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and communication. Antonie Leeuwenhoek 2002; 81, 639–54.
51. Jack, R. W., Tagg, J. R., Bibek, R.: Bacteriocins from gram-positive bacteria. Microbiol. Rev. 1995; 59, 171–200.
52. Lai, A. C., Tran, S., Simmonds, R. S.: Functional characterization of domains found within a lytic enzyme produced by Streptococcus equi subsp. zooepidemicus. FEMS Microbiol. Lett. 2002; 215, 133–138.
53. Johnsen, L., Fimland, G., Nissen-Meyer, J.: The C‑terminal domain of pediocin-like antimicrobial peptides (class IIa bacteriocins) is involved in specific recognition of the C-terminal part of cognate immunity proteins and in determining the antimicrobial spectrum. J. Biol. Chem. 2005; 280, 9243–9250.
54. Zouhir, A., Hammami, R., Fliss, I., Hamida, J. B.: A new structure-based classification of gram-positive bacteriocins. Protein J. 2010; 29, 432–439.
55. Thomas, L. V., Clarkson, M. R., Delves-Broughton, J.: Nisin. In: Naidu, A. S. ed. Natural food antimicrobial systems, 1st ed. New York, CRC Press, 2000.
56. Schillinger, U., Geisen, R., Holzapfel, H. W.: Potential of antagonistic microorganisms and bacteriocins for the biological preservation of foods. Trends Food Sci Tech. 1996; 7, 158–164.
57. Stiles, M. E.: Biopreservation by lactic acid bacteria. Antonie Leeuwenhoek 1996; 70, 331–345.
58. Gálvez, A., Abriouel, H., López, R. L., Omar, N. B.: Bacteriocin-based strategies for food biopreservation. Int. J. Food Microbiol 2007; 120, 51–70.
59. Kecerová, K., Pristaš, P., Javorský, P.: Bacteriocin production and sensitivity. Folia Microbiol. 2004; 49, 172–174.
60. Hammami, R., Zouhir, A., Le Lay, Ch., Hamida, J. B., Fliss, I.: BACTIBASE second release: a database and tool platform for bacteriocin characterization. BMC Microbiol. 2010; 10, 22–27.
61. Kiňová Sepová, H., Bilková, A., Bilka, F., Bezáková, L.: Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia. Čes. slov. Farm. 2010; 59, 155–159.
Štítky
Farmacie Farmakologie
Článek Peletizace tavenin a kapalinČlánek Nové knihyČlánek Nové knihyČlánek Ocenenie Viere Jeníkovej
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2011 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Nedůvěřivý pacient – tipy pro efektivní komunikaci v časové tísni
- MUDr. Václav Šmíd, Ph.D.: Jaterní fibróza a iniciální stadia cirhózy jsou potenciálně vratné stavy
-
Všechny články tohoto čísla
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Peletizace tavenin a kapalin
- Kručinka barvířská (Genista tinctoria L.) – obsahové látky a biologická aktivita
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Nové knihy
- Štúdium lokálnych anestetík – časť 194*Hodnotenie karbopolových hydrogélov s lidokaínom
- Analytické hodnotenie mono[{3-[4-(2-etoxyetoxy)-benzoyloxy]-2-hydroxypropyl}-izo-propylamónium]fumarátu
- Nové knihy
- Ocenenie práce pani doc. RNDr. Ive Valáškovej, CSc.
- Ocenenie Viere Jeníkovej
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Generická substituce, záměny a náhrady léčiv – současný rozsah
- Myasthenia gravis – současné terapeutické možnosti a nové trendy
- Bakteriocíny produkované baktériami mliečneho kvasenia
- Peletizace tavenin a kapalin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



